
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретичне обгрунтування
|
|
Лабораторна робота № 12 (2 години)
Тема Приготування стандартних розчинів хлоридної кислоти і натрій тетрабората
1 Мета Вивчити методи приготування стандартного розчину хлоридної кислоти за об’ємом концентрованої кислоти та стандартного розчину натрій тетрабората по наважці х.ч. сполуки. Навчитись користуватися ареометром, довідковою літературою, мірним посудом та обчислювальними формулами титрометричного аналізу
2 Матеріальне забезпечення
2.1 Ареометр
2.2 Бюкса скляна
2.3 Ваги аналітичні ВЛА – 200г -М
2.4 Технічні ваги ВЛТА -500
2.5 Воронка скляна
2.6 Колба мірна 250 см3
2.7 Колба мірна 100 см3
2.8 Циліндр мірний 50 см3
2.9 Кислота хлоридна, концентрована НСl
2.10 Натрій тетраборат (бура), кристалічний Na2B4O7*10Н2О
Теоретичне обгрунтування
Натрій тетраборат і хлоридна кислота – стандартні розчини кислотно – основного метода аналізу. Натрій тетраборат Na2B4O7*10Н2О, кристалічна сполука, відповідає вимогам до «вихідних» речовин, тому його стандартний розчин готуємо з точної наважки, зваженої на аналітичних вагах, яку розчиняємо в точному об’ємі, тобто в мірній колбі.
Хлоридна кислота HCl не відповідає вимогам “вихідних” речовин, так як існує у вигляді розчина з W(HCl) = 30-36%. Тому необхідно обчислити об’єм концентрованої кислоти, необхідний для приготування розчину з приблизною еквівалентною концентрацією.
Натрій тетраборат Na2B4O7*10Н2О – сіль, утворена сильною основою або слабкою кислотою, підлягає гідролізу, її розчин має лужну реакцію, в результаті утворюється натрій гідроксид. Хлоридна кислота реагує з лугом, тому концентрація лугу зменшується, і рівновага гідролізу зміщюється в сторону утворення борної кислоти і солі:

 Na2B4O7 + 7H2O 2NaOH + 4H3BO3
Na2B4O7 + 7H2O 2NaOH + 4H3BO3
 2NaOH + 2HCl ® 2NaCl + 2H2O
2NaOH + 2HCl ® 2NaCl + 2H2O
Na2B4O7 + 5H2O + 2HCl ® 2NaCl + 4H3BO3 рН< 7
В результаті реакції середовище буде кислим, так як утворюється борна кислота, тому момент еквівалентності фіксуємо метил оранжевим (рТ=4) або матил червоним (рТ= 5, 5).
М 381, 37 г/моль
М(е) (Na2B4O7 * 10H2O) = ----- = --------------------- = 190, 7 г/моль
2 2
М
М(е)(НСl) = ------- = 36, 5 г/моль
4 Хід роботи
4.1 Приготування стандартного розчину натрій тетраборату
За нижче вказаною формулою розрахуйте наважку бури, необхідну для приготування 100 см3 розчину, еквівалентна концентрація якого С(е) = 0, 1 моль/дм3:
 Се (Na2B4O7 * 10H2O) = 0, 1 моль/дм3 Ме (бури) * С(е) бури * Vк(бури)
Се (Na2B4O7 * 10H2O) = 0, 1 моль/дм3 Ме (бури) * С(е) бури * Vк(бури)
Ме (Na2B4O7 * 10H2O) = 190, 7 г/моль m (бури) = -----------------------------------------------
V (Na2B4O7 * 10H2O) = 100 см3 1000
 |
m (Na2B4O7 * 10H2O) -?
В попереднє зважену бюксу на аналітичних вагах візьміть наважку Na2B4O7*10Н2О біля 2 г з точністю до 0, 0002 г і перенесіть через воронку в мірну колбу ємкістю 100 см3. Наважку натрій тетраборату розчиніть у невеликому об’ємі дистильованої води, а потім доведіть до мітки за допомогою піпетки.
Розчин перемішайте, закрийте колбу пробкою і розрахуйте титр і еквівалентну концентрацію формулами 4.1.1 та 4.1.2:
m
Т бури = --------, (4.1.1)
V
Т * 1000
Се (бури) = ------------------, (4.1.2)
Ме (бури)
4.2 Приготування розчину хлоридної кислоти
Для того, щоб приготувати розчин хлоридної кислоти приблизної еквівалентної концентрації, (С(е) = 0, 1 моль/дм3) з концентрованого розчину необхідно виконати слідуючи дії:
4.2.1 Визначити за допомогою ареометру (денсиметру) густину концентрованої хлоридної кислоти - HСl (r г/см3). Налийте концентровану хлоридну кислоту в високий циліндр і занурте ареометр. Увага! Виміряти густину НСl необхідно тільки під витяжною шафою;
4.2.2 визначивши густину хлоридної кислоти, за справочною таблицею знайдіть відповідну їй масову частку (%). Наприклад, густині хлоридної кислоти 1, 179 г/см3 відповідає 36%-ний розчин HСl;
4.2.3 Всі дані зведіть в таблицю:
 |
Ce (HCl) =
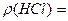
V (HCl) =
W (HCl) =
C(HCl) =
Me (HCl) =
 |
V (конц.HCl) -?
4.2.4 Обчисліть об’єм хлоридної кислоти з даною часткою, необхідну для приготування 250 см3 розчину з еквівалентною концентрацією 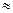 0, 1 моль/дм3 за формулами 4.2.4.1; 4.2.4.2 та 4.2.4.3
0, 1 моль/дм3 за формулами 4.2.4.1; 4.2.4.2 та 4.2.4.3
w * r* 1000 10 * w* r
С(е) (HСl) = ----------------------- = --------------, (4.2.4.1)
100 * Ме (HСl) Ме(HСl)
Vконц * C(е) конц = V розв. * С(е) розв., (4.2.4.2)
V розв. * С(е) розв.
Vконц = ------------------------------, (4.2.4.3)
C(е) конц
4.2.5 В мірну колбу налийте дистильованої води біля 200 см3, туди ж влийте обчислений і відміряний мірним циліндром об’єм (2, 2 см3) концентрованої хлоридної кислоти і доведіть водою рівень розчину до мітки. Склянку закрийте пробкою та обережно перемішайте.
5 Контрольні питання
5.1 Дайте визначення титру. За якими формулами його обчислюють?
5.2 Які розчини називають стандартними? Охарактеризуйте методику їх приготування.
5.3 Обчислить наважку соди Na2СО3 необхідно для приготування 250 см3 розчину з еквівалентною концентрацією якого 0, 1 моль/дм3.
5.4 В мірній колбі на 500 см3 розчинили 6, 3 щавелової кислоти Н2С2О4*2Н2О. Обчислити Т і С(е) розчину кислоти.
5.5 Визначте еквівалентну концентрацію розчину сульфатної кислоти, масова частка (w) якої 20%, а густина - 1, 493 г/см3.
5.6Обчисліть молярну концентрацію еквіваленту нітратної кислоти, якщо титр її розчину складає 0, 003764г/см3.
5.7 Наведіть приклади вихідних речовин. Яким вимогам вони повинні відповідати?
5.8 Що таке момент еквівалентності і як його фіксують? Наведіть приклади.
5.9 Вкажіть показники титрування фенолфталеїну і лакмуса. Що таке рН індикатора?
5.10 Підберіть індикатор для таких випадків титрування:
- Na2CO3 i H2SO4;
- NH4OH i HNO3;
- Ba(OH)2 i HCl;
- NaHCO3 i HCl.
6 Література
6.1 Барсукова З.А. Аналитическая химия. М. “Высшая школа” 1990, 319 с.
6.2 Понадич И.А., Траунберг С.Е. и др. Аналитическая химия. М. “Химия” 1989 г 237 с.
6.3 Алексеев В.Н. Количественный а