
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Типы химических связей
|
|
При образовании химической связи происходит перераспределение в пространстве электронных плотностей, первоначально принадлежавших разным атомам. Поскольку наименее прочно связаны с ядром электроны внешнего уровня, то этим электронам принадлежит главная роль в образовании химической связи. Количество химических связей, образованных данным атомом в соединении, называют валентностью. Электроны, принимающие участие в образовании химической связи, называются валентными. В зависимости от характера их распределения различают три основных типа химической связи: металлическую, ионную и ковалентную.
Ковалентная связь образуется парой электронов, принадлежащих двум атомам. При этом происходит перекрывание атомных орбиталей, повышение электронной плотности в пространстве между ядрами и их стягивание. Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма (рис. 8), когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
Ионная связь — частный случай ковалентной, когда образовавшаяся пара электронов полностью принадлежит одному из атомов, становящихся анионом (отрицательно заряженным ионом). Таким образом ионная связь – это связь между противоположно заряженными ионами, когда атомы одного элемента легко отдают внешний электрон (например, щелочные металлы), а атомы другого элемента присоединяют электрон (например атомы галогенов). Образующиеся ионы электростатически притягиваются друг к другу.
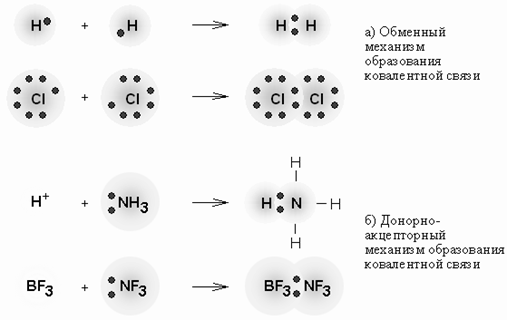
Рис. 8. Механизмы образования ковалентной связи.
Металлическая связь существует в металлах в твердом в жидком состоянии. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов (1-3) и низкую энергию ионизации (отрыва электрона). Поэтому валентные электроны слабо удерживаются в атоме, легко отрываются и имеют возможность перемещаться по всему кристаллу. В узлах кристаллической решетки металлов находятся свободные атомы, положительно заряженные коны, а часть валентных электронов, свободно перемещаясь в объеме кристаллической решетки, образует «электронный газ», обеспечивающий связь между атомами металла. Связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке, называется металлической связью. Металлическая связь возникает за счет обобществления атомами валентных электронов.
Основные понятия органической химии
Органическая химия — это химия углеводородов и их производных. Благодаря особым свойствам элемента углерода, органические соединения очень многочисленны. Сейчас известно свыше 20 миллионов синтетических и природных органических веществ, и их число постоянно возрастает.
Теория химического строения органических веществ сформулирована A.M. Бутлеровым в 1861 г. В современной структурной теории органических соединений основными являются следующие положения:
1. Атомы в органических молекулах соединены между собой в определенном порядке химическими связями в соответствии с валентностью. Их многообразие определяется прежде всего электронным строением атома углерода, который во всех органических соединениях четырехвалентен.
2. Порядок соединения атомов называется химическим строением, которое можно выразить структурной формулой.
3. Физические и химические свойства вещества зависят не только от их качественного и количественного состава, но и от строения молекул. Вещества, имеющие одинаковый качественный и количественный состав (одинаковую молекулярную формулу), но разное строение молекул, называются изомерами. Например, н-бутан и изобутан (рис. 9) имеют одинаковую молекулярную формулу С4Н10, но разное строение молекул и физические свойства (в частности, температуру кипения).
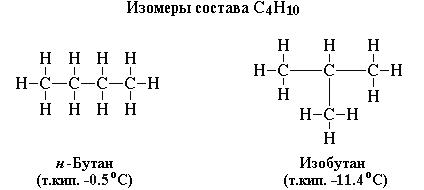
Рис. 9. Изомеры соединения С4Н10.
Соединения, в состав которых входят только углерод и водород, называются углеводородами. Предельные углеводороды содержат только одинарные связи С—С и С—Н. Непредельные (ненасыщенные) углеводороды содержат одну или несколько двойных связей. Другие, более многочисленные, органические соединения можно рассматривать как производные углеводородов, которые образуются при введении в углеводороды функциональных групп, содержащих другие элементы. В зависимости от природы функциональных групп органические соединения делят на классы (рис. 10). Все классы органических соединений взаимосвязаны. Переход от одних классов соединений к другим осуществляется в основном за счет превращения функциональных групп без изменения углеродного скелета. Соединения каждого класса составляют гомологический ряд. Гомологи — это соединения, принадлежащие к одному классу, но отличающиеся друг от друга по составу на целое число групп -СН2-. Гомологи обладают весьма похожими физическими и химическими свойствами.
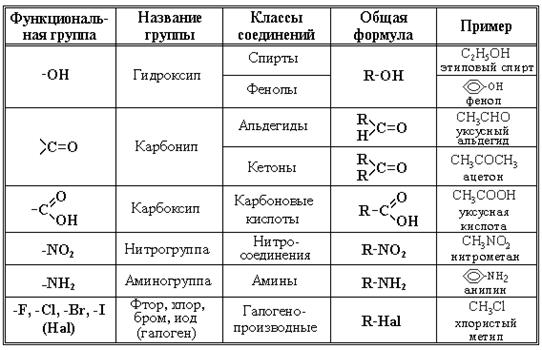
Рис. 10. Основные классы органических соединений.
Вопросы для самоконтроля:
1. Дайте определение терминам «атом», «химический элемент», «изотоп», «молекула».
2. Обладает ли одна молекула вещества его физическими свойствами? Почему?
3. Сколько молекул находится в двух молях воды?
4. В состоит особенность металлической связи?
5. Раскройте донорно-акцепторный механизм образования ковалентной связи.
6. Сформулируйте принцип Ле-Шателье. Как, согласно данному принципу, сместить равновесие в сторону эндотермической реакции?
7. Приведите примеры изомеров и гомологов органических соединений.