
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние катализаторов на скорость реакции
|
|
Катализатор – это вещество, которое увеличивает скорость реакции, само оставаясь по окончании реакции химически неизменным. Соответственно, катализ – это ускорение химической реакции в присутствии катализаторов. Термины «катализатор» и «катализ» (от греч. κ α τ α λ ι σ ι ς – разрушение) в 1835 г. ввёл в научный обиход Й.Я. Берцелиус. Например, добавление в качестве катализатора небольшого количества диоксида марганца MnO2 к пероксиду водорода H2O2 вызывает его бурное разложение:
2H2O2(р.) 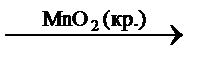 2H2O(ж.) + O2(г.).
2H2O(ж.) + O2(г.).
Огромное практическое значение катализаторов обусловлено возможностью быстро, без затраты энергии получать в больших количествах разнообразные вещества.
Выделяют следующие виды катализа:
1. Гомогенный катализ – катализатор и реагенты находятся в одной и той же фазе, т. е. катализатор равномерно распределён в реакционном объёме. Типичные катализаторы для гомогенного катализа: кислоты, основания, некоторые комплексы металлов. Например:
– каталитические гомогенные реакции в газовой фазе:
2CO(г.) + O2(г.) 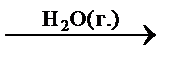 2CO2(г.),
2CO2(г.),
C8H18(г.) + 12, 5O2(г.) 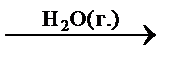 8CO2(г.) + 9H2O(г.),
8CO2(г.) + 9H2O(г.),
CH3COH(г.)  CH4(г.) + CO(г.);
CH4(г.) + CO(г.);
– каталитическая гомогенная реакция в жидкой фазе:
2H2O2(р.)  2H2O(ж.) + O2(г.).
2H2O(ж.) + O2(г.).
2. Гетерогенный катализ – катализатор и реагенты находятся в разных фазах. Обычно гетерогенный катализ происходит на поверхности твёрдого тела – катализатора. Типичные катализаторы для гетерогенного катализа: переходные металлы (d -элементы) и их оксиды (прежде всего следующие металлы: Cr, Mn, Fe, Co, Ni, Cu, Mo, Pd, Ag, W, Pt, Au). Например: разложение H2O2(р.) на поверхности кристаллического MnO2 (см. выше) или:
2CO(г.) + O2(г.) 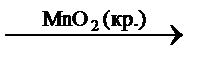 2CO2(г.),
2CO2(г.),
O2(г.)  2O.
2O.
3. Ферментативный катализ – катализ в живых организмах, обусловленный действием ферментов (от лат. fermentum – закваска). Ферменты являются высокомолекулярными соединениями – белками или комплексами белков с низкомолекулярными соединениями. Их размеры значительно превышают размеры ионов и молекул в растворах, поэтому ферменты иногда называют микрогетерогенными катализаторами, а ферментативный катализ – микрогетерогенным, занимающим промежуточное положение между гомогенным и гетерогенным катализом. Например, ферментативные реакции:
– превращение крахмала в глюкозу,
– гидролиз эфиров,
– расщепление белков,
– разложение пероксида водорода,
– дегидратация CO2 из крови,
– превращение этанола в уксусный альдегид.
В последнем примере окислителем является никотинамидадениндинуклеатид (NAD+), ферментом – алкогольдегидрогеназапечени (ПАДГ, алкоголь: NAD+-оксидоредуктаза, Enzyme Classification 1.1.1.1):
C2H5OH(р.) + NAD+  CH3COH(р.) + NADH + H+.
CH3COH(р.) + NADH + H+.
Многие ферменты обладают значительной активностью. Например, фермент каталаза увеличивает скорость реакции разложения пероксида водорода на более чем 10 порядков.
Катализаторы отличаются избирательностью (селективностью) действия. Так, на оксиде алюминия при температуре 350 – 360 °C происходит дегидратация этанола, а на меди при 200 – 250 °C – его дегидрирование:
C2H5OH(г.) 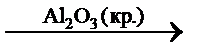 C2H4(г.) + H2O(г.),
C2H4(г.) + H2O(г.),
C2H5OH(г.) 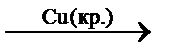 CH3COH(г.) + H2(г.).
CH3COH(г.) + H2(г.).
В отсутствие катализатора обе реакции протекают параллельно.
Промоторы (активаторы) (от лат. promoveo — продвигаю) – это вещества, усиливающие действие катализаторов. Например: небольшая добавка сульфатов щелочных металлов в сотни раз повышает активностьV2O5(кр.) – катализатора окисления SO2 в SO3.
Каталитические яды – это вещества, способные в очень малых количествах снижать (и даже полностью подавлять) активность катализаторов. Иногда такие вещества называют ингибиторы (от лат. inhibeo – останавливаю, сдерживаю). Например: кислород и его соединения вызывают отравление катализатора Fe(кр.) при синтезе NH3.
Механизм многих каталитических реакций очень сложен и для некоторых из них до сих пор не выяснен. В 1882 – 87 гг. Ф.В. Оствальдом была выдвинута идея о том, что в общих чертах действие катализатора заключается в изменении пути реакции и понижении энергии активации Ea.
На рис. 3.5 изображена энергетическая диаграмма пути реакции обмена общего вида:
AB + CD ® AC + BD.
В ходе реакции система проходит через переходное состояние – образование активированного комплекса:
| A – B | 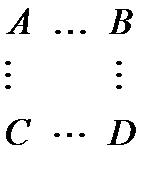
| A B | ||
| + | ® | ® | ç + ç | |
| C – D | C D | |||
| Молекулы реагентов | Активированный комплекс | Молекулы продуктов |
В активированном комплексе старые связи ещё не разорваны, но уже ослаблены, а новые связи наметились, но ещё не образовались. Время существования комплекса невелико (порядка 10–13с). Несмотря на то, что данная реакция является экзотермической, т. е. идёт с выделением тепла (D H < 0), для образования активированного комплекса необходима энергия активации Ea 1. Т. е. системе необходимо преодолеть довольно высокий энергетический барьер. Наличие такого барьера является причиной того, что многие химические реакции при невысоких температурах не протекают, хотя и принципиально возможны (D GP , T < 0). Например, в обычных условиях самопроизвольно не загораются такие материалы, как дерево, ткани, бумага, уголь, бензин и т. д. – необходимо сообщить этим материалам энергию активации (проще говоря, поджечь).
При использовании в реакции катализатора kat активированный комплекс образуется из молекул реагентов и катализатора. Энергия активации, требуемая для образования такого комплекса ниже (на рис. 3.5 Ea 2 < Ea 1). В некоторых случаях каталитические реакции протекают с образованием не одного, а двух и более активированных комплексов. Однако суммарная энергия активации каталитического процесса всё равно ниже, чем реакции без катализаторов. Снижение энергии активации в присутствии катализаторов бывают очень значительными. Например, энергия активации реакции:
2HI(г.) ® H2(г.) + I2(г.)
снижается со 184 до 105 кДж при использовании в качестве катализатора золота, а при использовании более активной платины снижается до 69 кДж.
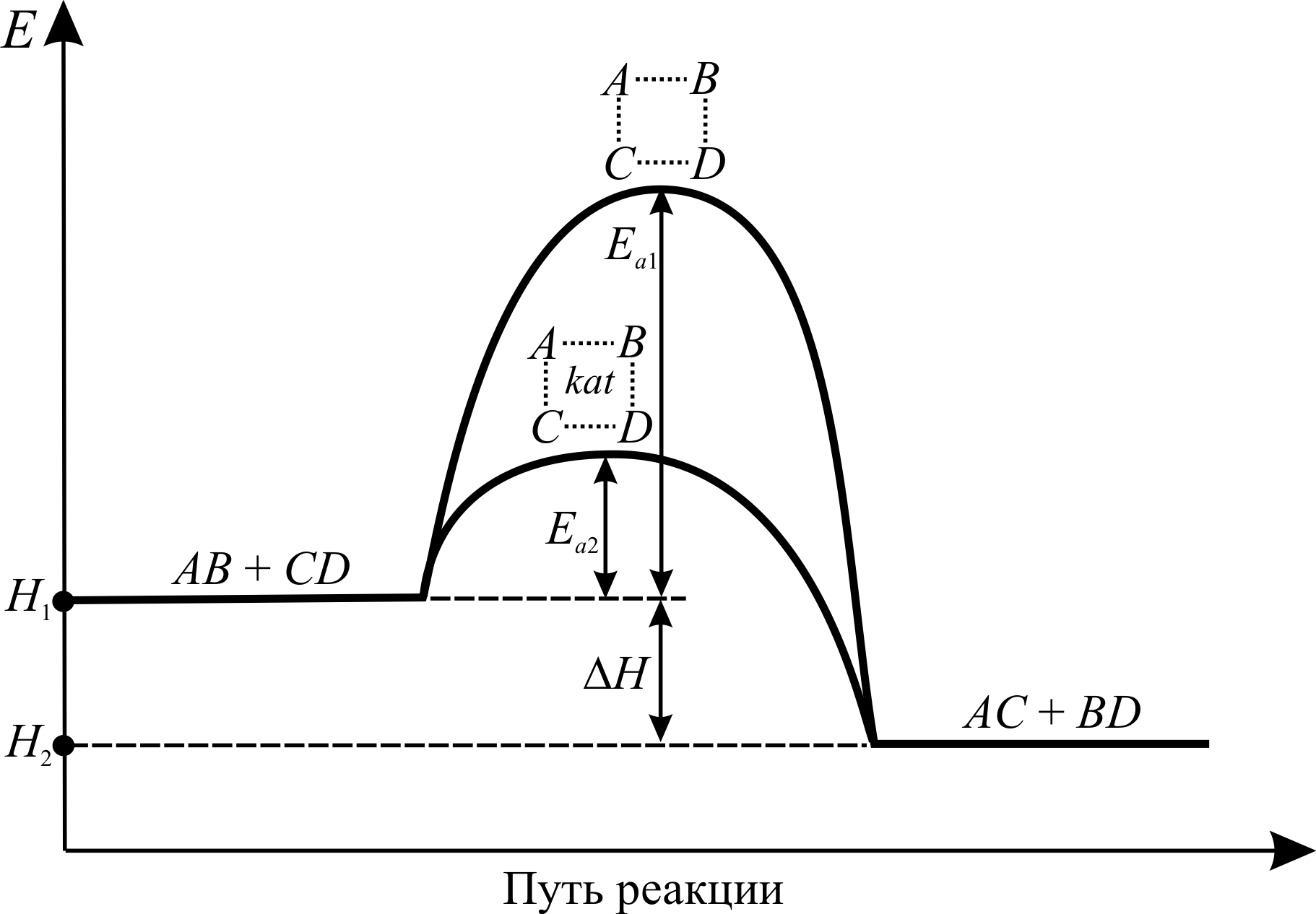
Рис. 3.5. Энергетическая диаграмма пути реакции
Другой пример (биохимический) – гидролиз цитидин-2′ -3′ -циклофосфата
(промежуточный этап гидролиза рибонуклеиновой кислоты РНК):
– прямой гидролиз водой: Ea = 71  ;
;
– гидролиз, катализируемый имидазолом : Ea = 46
 ;
;
– гидролиз, катализируемый панкреатической рибонуклеазой (фермент, катализирующий гидролиз фосфодиэфирных связей в РНК, Enzyme Classification 3.1.27.5): Ea = 4, 2  [Кнорре, 214].
[Кнорре, 214].