
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическое равновесие
|
|
Обратимые химические реакции – это реакции, протекающие одновременно в двух противоположных направлениях. Вследствие обратимости реакции не доходят до конца. В ходе таких реакций концентрации исходных веществ уменьшаются, а вместе с этим уменьшается и скорость прямой реакции uпр. Одновременно растут концентрации продуктов реакции, и скорость обратной реакции возрастает uобр. Всё это приводит к тому, что разность скоростей прямой и обратной реакции уменьшается и падает до нуля. В последнем случае скорости прямой uпр и обратной uобр реакций становятся одинаковыми:
uпр – uобр = 0; uпр = uобр.
Подобное состояние системы соответствует химическому равновесию. В указанных условиях концентрации реагирующих веществ становятся вполне определёнными и постоянными во времени и называются равновесными.
Пример 2. Рассмотрим гомогенную обратимую двухмолекулярную реакцию второго порядка, происходящую при постоянной температуре:
Н2(г) + J2(г) = 2 HJ(г).
Решение. В момент равновесия uпр = uобр или kпр [H2] [J2] = kобр [HJ]2, преобразуя данное уравнение, получим
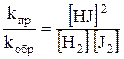 ;
; 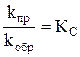 ;
; 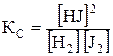 , (6)
, (6)
где [Н2], [J2], [HJ] – равновесные концентрации, моль/л; Кс – константа равновесия, величина постоянная, независящая от концентрации веществ; индекс «с» указывает на то, что К выражена через равновесные концентрации веществ.
Таким образом, для обратимых химических реакции, протекающих при постоянной температуре, отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, возведенных в степени, равные их стехиометрическим коэффициентам, есть величина постоянная, равная константе равновесия. Константа равновесия – это количественная характеристика состояния химического равновесия и представляет собой математическое выражение ЗДМ для обратимых простых реакций. Для гетерогенных обратимых химических реакций в выражение для константы равновесия входят только равновесные концентрации жидких или газообразных веществ.
Константу равновесия многих реакций можно найти, не прибегая к экспериментальному определению равновесных концентраций. Для этого используют соотношение, связывающее константу равновесия с изменением энергии Гиббса:
DG0 = –R T lnKc = –2, 303 R T lgKc (7)
или для Т = 298 К и R = 0, 008314 кД ж/моль× К.
DG0 = –5, 706 lgKc (кДж/моль). (7а)
Изменение энергии Гиббса можно найти либо по известным DН0 и DS0 реакции, пользуясь уравнением
DG0 = DН0 – Т DS0, (8)
либо по известным стандартным изменениям энергии Гиббса образования веществ:
DG0 = 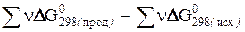 .
.
Пример 3. Рассчитайте константу равновесия реакции синтеза метана
С(тв) + 2 Н2(г) «СН4(г),
осуществляемого при 1300 °С, если DН0 и DS0 реакции соответственно равны
–75138 Дж/моль и –80, 976 Дж/моль× К.
Решение. Комбинируя уравнения (7) и (8), находим уравнение для константы равновесия:
DН0 – Т DS0 = –2, 3 R T lgKc или 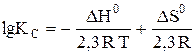 ,
,
подставляя данные в полученное уравнение, имеем
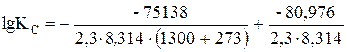 = –1, 725. Отсюда Кс = 1, 86× 10–2.
= –1, 725. Отсюда Кс = 1, 86× 10–2.
Состояние химического равновесия сохраняется при неизменных условиях (концентрации, температуре, давлении). Всякое изменение этих равновесных условий нарушает состояние равновесия, что приводит к нарушению равенства скоростей прямой и обратной реакций и смещению равновесия в том или ином направлении. При этом устанавливается новое равновесное состояние, отвечающее новым условиям. Истинное химическое равновесие характеризуется DG0 = 0. При таком значении изменения энергии Гиббса, согласно уравнению (2а), Кс = 1. Это значит, что kпр = kобр (см. уравнение 6), и значения равновесных концентраций исходных веществ и продуктов реакции одинаковы и равны 1 моль/л (стандартные концентрации). Если DG0 < 0, то Кс > 1 (kпр > kобр). Равновесие обратимого процесса смещено в сторону прямой реакции и устанавливается, когда в реагирующей смеси концентрация продуктов реакции больше, чем концентрация исходных веществ. При DG0 > 0, то Кс < 1 (kпр < kобр). В этом случае равновесие обратимого процесса смещено в сторону обратной реакции и устанавливается, когда в реакционной смеси находится больше исходных веществ, чем продуктов реакции.
Пример 4. Определите степень смещения химического равновесия для некоторой обратимой реакции, если 1) DG0 = 0; 2) DG0 = –39, 942 кДж/моль; 3) DG0 = 17, 118 кДж/моль.
Решение. Константа равновесия связана с изменением энергии Гиббса соотношением DG0=–5, 706 lgKc (см. уравнение 7а).
1. При DG0=0, Кс = 1 (kпр = kобр). Обратимая реакция находится в состоянии истинного равновесия при стандартных концентрациях.
2. DG0 = –39, 942 кДж/моль (DG0 < 0). В этом случае константа равновесия находится следующим образом:
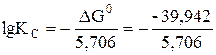 = 7, т.е. КС = 107 (Кс > 1).
= 7, т.е. КС = 107 (Кс > 1).
Следовательно, равновесие обратимой реакции смещено в сторону образования продуктов реакции.
3. DG0 = 17, 118 кДж/моль (DG0 > 0) константа равновесия находится так
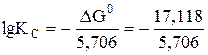 = –3, т.е. КС = 10–3 (Кс < 1).
= –3, т.е. КС = 10–3 (Кс < 1).
В этом случае равновесие обратимой реакции смещено в сторону образования исходных веществ.
Смещение химического равновесия подчиняется принципу Ле Шателье: если на систему, находящуюся в равновесии, оказать какое-либо внешнее воздействие (изменить температуру, концентрацию, давление), то это воздействие благоприятствует той из двух противоположных реакций, которая ослабляет оказанное воздействие.
Влияние температуры. При повышении температуры смещение равновесия происходит в сторону эндотермической реакции (DН > 0), а при понижении температуры – в сторону экзотермической реакции (DН < 0).
Пример 5. В какую сторону произойдет смещение равновесия в реакции СО2(г) + Н2(г) «CO(г) + H2O(г); D Н = 41 кДж при понижении температуры.
Решение. Реакция, протекающая в прямом направлении – эндотермическая (DН > 0), а в обратном направлении – экзотермическая (DН < 0). Следовательно, понижение температуры сместит химическое равновесие в сторону экзотермической реакции, т.е. в обратном направлении.
Влияние температуры на смещение химического равновесия применимо ко всем химическим системам вне зависимости от агрегатного состояния исходных веществ и продуктов реакции.
Влияние концентрации. На смещение химического равновесия влияет изменение только тех концентраций веществ, которые входят в выражение для константы равновесия. Таким образом, для гомогенных реакций изменение концентрации любого из реагирующих веществ вызовет смещение химического равновесия. Для гетерогенных реакций, протекающих на границе раздела «газ-твёрдое вещество», только изменение концентрации газообразного вещества влияет на смещение химического равновесия. В любом случае: увеличение концентрации исходных веществ смещает химическое равновесие в прямом направлении, а увеличение концентрации продуктов реакции – в обратном направлении.
Влияние давления. Влияние давления на смещение химического равновесия проявляется только при наличии в системе газов, реагирующих с изменением объёма (изменением количества газообразных веществ). В тех случаях, когда это не происходит, давление не влияет на состояние равновесия. При увеличении давления смещение равновесия происходит в сторону той (прямой или обратной) реакции, которая сопровождается уменьшением объёма, а уменьшение давления – в противоположную сторону, т.е. в сторону реакции, протекающей с увеличением объёма.
Пример 6. В какую сторону сместится равновесие при увеличении давления в следующих системах:
а) 2Н2(г) + О2(г) «2Н2О(г);
б) 2N2О(r) + S(г) «2N2(г) + SO2(г)?
Решение. По условию задачи давление увеличивается, поэтому смещение равновесия должно происходить, в сторону реакции, идущей с уменьшением объёма. Объёмы газообразных веществ пропорциональны стехиометрическим коэффициентам в уравнении реакции. В реакции (а) происходит уменьшение объёма DV < 0 (2 – 2 – 1 = –1), Следовательно, повышение давления смещает равновесие в прямом направлении. В реакции (б) учитываются объёмы только газообразных веществ. Прямая реакция сопровождается увеличением объема DV > 0
(2 + 1 – 2 = 1), а обратная – уменьшением объёма. Поэтому увеличение давления смещает равновесие в обратном направлении.