
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Алгоритм вычисления массы (m) продуктов реакции по заданному
|
|
количеству исходного вещества:
1) Записать условие задачи.
2) Составить уравнение реакции.
3) Подчеркнуть формулы веществ, о которых идет речь.
4) Записать исходные данные.
5) Рассчитать количество вещества.
6) Найти М определяемого вещества, зная что [M]=Mr.
7) Используем формулу 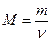 и вычисляем массу вещества
и вычисляем массу вещества 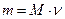 .
.
8) Записываем ответ.
Пример: Рассчитать массу (m) H2O, образовавшейся в результате взаимодействия 0, 5 моль оксида алюминия с серной кислотой при нагревании.
 |
Дано: Решение:
 n(Al2O3)=0, 5 моль 0, 5моль n моль
n(Al2O3)=0, 5 моль 0, 5моль n моль
Найти: Al2O3 + 3H2SO4 ® Al2(SO4)3 + 3H2O
M(H2O)-? 1 моль 3 моль
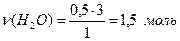
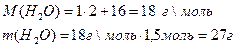
Задания для самоконтроля:
Задание № 1. Химической реакции в растворе отвечает уравнение: А+В=С. Как изменится скорость реакции если:
а) концентрацию А увеличить в 2 раза, оставив концентрацию В прежней,
б) концентрацию одного из веществ увеличить в 2 раза, а другого – в 2 раза уменьшить.
Задание № 2. При повышении температуры на 10º С скорость химической реакции возрастает в 2 раза. При 20º С она равна 0, 04. Какова будет скорость этой реакции при: а) 40º С, б) 10º С, в) 0º С, г) 20º С?
Задание № 3. В какую сторону сместится равновесие системы (влево или вправо) 2SO2+O2  2SO3+Q
2SO3+Q
а) при повышении температуры,
б) при повышении давления.
Задание № 4. Вычислите, какое количество теплоты поглощается при окислении 14г азота. Термохимическое уравнение реакции окисления азота:
N2+O2=2NO-180, 8 кДж.
Задание № 5. Напишите электронные уравнения, расставьте коэффициенты и укажите восстановитель и окислитель в следующих реакциях:
а) Mg+H2SO4=MgSO4+H2,
б) Zn+CuCl2=ZnCl2+Cu,
в) H2+J2=HJ,
г) O2+Na2SO3=Na2SO4.
Задание № 6. Методом электронного баланса подберите коэффициенты в схемах ОВР:
а) FeCl3+KJ=FeCl2+J2+KCl,
б) S+KOH=K2S+K2SO3+H2O,
в) MnS+НNО3=MnSO4+NO2+H2O.