
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Стационарное состояние биосистем. Устойчивое и неустойчивое стационарное состояние, точки бифуркации.
|
|
Стационарное состояние открытой системы. Состояние системы называется стационарным, если величина энтропии не изменяется во времени, то есть dS = 0. Это возможно, когда производство энтропии в системе полностью компенсируется энтропией, выходящей из системы. Стационарное состояние открытой системы имеет сходство с термодинамическим равновесием, поскольку оба состояния характеризуются устойчивостью характеризующих их параметров состояния. Обменивается энергией с окружающей средой: количество свободной энергии в системе необходимо поддерживать. Энтропия системы в стационарном состоянии - стабильная, но не максимальная. Градиенты и потоки сохраняются в системе. Основная характеристика стационарного состояния определена теоремой Пригожина, согласно которой производство энтропии в стационарном состоянии минимально (dS=min). Это означает, что система рассеивает минимальную энергию в среду и нуждается в минимальном поступлении свободной энергии для поддержания своего состояния. Теорема Пригожина объясняет устойчивость стационарных состояний в открытых системах. Если система выходит из этого состояния самопроизвольно, происходит увеличение энтропии. В результате в системе возникают процессы, которые стремятся возвратить её в стационарное состояние. Многие физиологические параметры являются достаточно стабильными. Их стационарный уровень регулируют специальные физиологические механизмы. В качестве примера поддержания стационарного состояния можно привести терморегуляцию организма. Постоянство температуры обеспечивается поддержанием баланса теплопродукции и теплоотдачи. В результате температура тела поддерживается неизменной, несмотря на колебания внешней температуры. Механизмы, с помощью которых живые организмы поддерживают гомеостаз, то есть статические условия своей внутренней среды, изучает физиология.
59. Типы объемных взаимодействий в молекуле белка: водородные связи, физическая природа водородных связей.
Межмолекулярная водородная связь возникает между молекулами, в состав которых входят водород и сильно электроотрицательный злемент - фтор, кислород, азот, реже хлор, сера. Поскольку в такой молекуле общая электронная пара сильно смещена от водорода к атому электроотрицательного элемента, а положительный заряд водорода сконцентрирован в малом объеме, то протон взаимодействует с неподеленной электронной парой другого атома или иона, обобществляя ее. В результате образуется вторая, более слабая связь, получившая название водородной. Она ответственна за ассоциацию молекул. Вторичная структура белка образуется за счет водородных связей. В ее образовании участвуют только элементы остова белка. Связь образуется между О2 карбонильной группы пептидной связи и водородом азота другой пептидной связи. Вторичн. ст-ра бывает упорядоченной и неупорядоченной. Упорядоченная- мы можем выделить правило и порядок образования водородн. связи (какая АК с какой взаимодействует). Неупорядоченная- нельзя выделить правило образования водородной связи (но в конкретном белке в его определенном участке водород. связи образуются строго между определенными АК). Третичная ст-ра белка. Водородные связи. В данном случае в качестве донора могут выступать атомы N2, O2, S, C. В качестве акцептора Н2. В образовании связи могут участвовать как элементы остова, так и радикалы (остов-остов, радикал-радикал, остов-радикал). Водородн. связь слабая, но молекуле белка их насчитывается 1000, десятки тысяч и более.
60 Типы объемных взаимодействий в молекуле белка: силы Ван-дер-Ваальса.
Ван-дер Вальсовые взаимодействия встречаются в третичной структуре белка. Это взаимодействия атомов между собой при очень близких расстояниях. Обусловлены: 1)силы притяжения между ядром одного атома и электронной оболочкой другого 2)силами столкновения электронных оболочек атомов. Если мы сближаем атомы, то на расстоянии  сумме радиусов, возникают силы притяжения. Они нарастают, но, когда атомы почти касаются друг друга, возникают силы отталкивания и атомы начинают удаляться друг от друга. В результате атомы останавливаются друг относительно друга, когда силы притяжения и отталкивания уравновешены- возникло Ван-дер-Ваальсово взаимодействие. Данное взаимод. описывается с использованием потенциала Линард-Джонса
сумме радиусов, возникают силы притяжения. Они нарастают, но, когда атомы почти касаются друг друга, возникают силы отталкивания и атомы начинают удаляться друг от друга. В результате атомы останавливаются друг относительно друга, когда силы притяжения и отталкивания уравновешены- возникло Ван-дер-Ваальсово взаимодействие. Данное взаимод. описывается с использованием потенциала Линард-Джонса 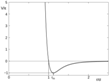 . Ван-дер-Вальсовы взаимодействия являются самыми слабыми в полимерах, но в белках их насчитывается сотни тысяч, миллионы и они играют существенную роль.
. Ван-дер-Вальсовы взаимодействия являются самыми слабыми в полимерах, но в белках их насчитывается сотни тысяч, миллионы и они играют существенную роль.