
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Стехіометричні розрахунки. Ступінь перетворення
|
|
ЗМІСТ
| ВСТУП..…………………………………………………..................................... | |
| 1. ОСНОВНІ ЗАКОНИ І ЗАКОНОМІРНОСТІ ХІМІЧНОЇ ТЕХНОЛОГІЇ.. | |
| 1.1. Стехіометричні розрахунки. Ступінь перетворення ………………….. | |
| 1.2. Закономірності газоподібних речовин …………………………………. | |
| 1.3. Визначення складу реакційних сумішей. Розрахунок молекулярної маси суміші ………………………………………………………………............ | |
| 2. МАТЕРІАЛЬНИЙ БАЛАНС У ХІМІЧНОМУ ВИРОБНИЦТВІ………….. | |
| 2.1. Швидкість хімічної реакції. Рівновага В ХТП …………………………... | |
| 2.2. Розрахунок матеріального балансу ………………….……………....................... | |
| 2.3. Індивідуальне завдання…………………………………………………….. | |
| 2.4. Теми рефератів для самостійного вивчення…………………………….... | |
| СПИСОК ЛІТЕРАТУРИ …………………………………………...................... |
ВСТУП
Хімічна промисловість відіграє важливу роль в економічному розвитку практично всіх галузей промисловості та сфери послуг, визначаючи через використання хімічних матеріалів та кінцевої хімічної продукції їх конкурентоспроможність. Рівень хімізації є загальновизнаним критерієм суспільно-економічного розвитку будь-якої країни. У промислово розвинених країнах частка хімічної продукції в промисловому виробництві складає від 5-8 до 13-16%. Без розвитку хімічної промисловості неможливе поліпшення стану навколишнього середовища, вирішення таких глобальних проблем, як нестача продовольчих і енергетичних ресурсів.
Фахівці з економіки хімічної промисловості повинні знати особливості і специфіку хімічного виробництва, способи раціональної та екологічно безпечної технології отримання хімічних продуктів. Кожен хіміко-технологічний процес (ХТП), як основний елемент хімічного виробництва, є сукупністю хімічних і фізико-хімічних перетворень, коли з первинної сировини утворюються речовини зі заздалегідь заданими властивостями. Необхідно чітко уявляти собі закономірності цих перетворень. Останні детально розглянуто в курсах хімії, фізики й узагальнено відповідно до реального виробництва в дисципліні «Техніка і технологія галузі».
Формування в студентів науково обґрунтованих знань і навичок їх використання для хіміко-технологічних процесів є метою практичного вивчення курсу «Техніка і технологія галузі».
Методичні вказівки для самостійної роботи студентів спрямовано на формування в студентів досвіду в проведенні розрахунків відповідно до стехіометричних співвідношень, ступеня перетворення сировини, виходу продукту в ході виробництва, визначення складу реакційних сумішей, а також вміння складати матеріальні баланси ХТП.
Самостійна робота студентів з дисципліни «Техніка і технологія галузі» складається з трьох етапів:
– виконання домашніх завдань (7 тетраместр);
– розрахунок індивідуального завдання (8 тетраместр);
– опрацювання теми для самостійного вивчення та оформлення у вигляді реферату (8 тетраместр).|передбачає|
1. ОСНОВНІ ЗАКОНИ І ЗАКОНОМІРНОСТІ ХІМІЧНОЇ
ТЕХНОЛОГІЇ
Стехіометричні розрахунки. Ступінь перетворення
Основою технологічних розрахунків є два закони: закон збереження маси речовини і закон стехіометричних співвідношень реагуючих речовин. Згідно з останнім, якщо відомо кількість однієї з реагуючих речовин, то завжди можна визначити кількість всіх інших учасників перетворення.Основою розрахунків хіміко-технологічних процесів є рівняння хімічної реакції.
Хімічне рівняння – це скорочений запис хімічних реакцій за допомогою символів і формул.
Розрахунки за хімічними рівняннями засновані на законі збереження маси речовини. Хімічне рівняння показує не тільки якісний склад реагентів, але і їх кількісне співвідношення, яке має назву стехіометрія.
Так, для отримання аміачної селітри необхідне співвідношення початкових компонентів один до одного (1 моль: 1 моль):
NH3 + HNO3 = NH4NO3
1 моль 1 моль 1моль.
Якщо в реальному процесі бере участь 10 кмоль аміаку, то відповідно до стехіометрії, азотної кислоти необхідно також взяти 10 кмоль.
Наступний приклад свідчить, що залежно від того, в яких співвідношеннях узято початкові реагенти, можна отримувати різні продукти:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
1 моль: 2 моль: 1 моль: 2 моль;
H2SO4 + NaOH = NaНSO4 + H2O
1 моль: 1 моль: 1 моль: 1 моль.
У реальному багатотоннажному виробництві оперують категорією кмоль (103моль), і розраховують витрату однієї речовини за відомою витратою іншої. Наприклад, для першої реакції отримання 100 кмоль сульфату натрію (Na2SO4) необхідно 100 кмоль сірчаної кислоти і 200 кмоль лугу. Стехіометрія дозволяє, знаючи кількість речовини одного з учасників процесу, перерахувати кількість усіх інших реагентів.
Ступенем перетворення (XА) реагенту A реакції: A + B = R – називається відношення кількості молей речовини А, яке зазналоперетворення, до початкової кількості молей цієї ж речовини:
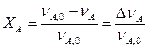 , (1)
, (1)
де nA, 0 – кількість реагенту А на початку процесу;
nA – кількість речовини А після протікання процесу, інакше кажучи кількість сировини А, що не вступила у перетворення;
Δ nA – зміна кількості речовини А в результаті реакції.
Для речовини В наведеної вище реакції ступінь перетворення визначається аналогічно. Отже, ступінь перетворення – це відношення кількості реагенту, що вступив у реакцію, до його початкової кількості.