
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Виды коагуляции электролитами
|
|
При коагуляции золя электролитами различают концентрационную коагуляцию и нейтрализационную коагуляцию.
Концентрационная коагуляция имеет место, когда она происходит под действием индифферентного электролита вследствие сжатия диффузного слоя противоионов и уменьшения абсолютного значения дзета-потенциала.
Рассмотрим концентрационную коагуляцию золя хлорида серебра, стабилизированного нитратом серебра, при введении в золь нитрата калия.
Формула мицеллы имеет вид:
{n[ AgCl] *• mAg+ * (m - x)NO3- }x+*xNO3-
На рис. 10.3 показан график изменения потенциалов ДЭС мицеллы хлорида серебра. Кривая 1 относится к исходной мицелле, кривая 2 – после добавления KNO3 в количестве, вызывающем коагуляцию. При добавлении KNO3 диффузный слой противоионов сжимается, формула мицеллы приобретает вид:
{n[AgCl]*mAg+*mNO3-}
На рис. 10.4 представлены потенциальные кривые, характеризующие взаимодействие частиц в этом золе. Дзета-потенциал исходной коллоидной частицы положительный, это создает потенциальный барьер коагуляции  > 0 (кривая 1). Поэтому при столкновении коллоидные частицы отталкиваются друг от друга, коагуляция не происходит. После добавления нитрата калия дзета – потенциал становится равным нулю и
> 0 (кривая 1). Поэтому при столкновении коллоидные частицы отталкиваются друг от друга, коагуляция не происходит. После добавления нитрата калия дзета – потенциал становится равным нулю и  = 0 (кривая 2). Поэтому ничто не мешает коллоидным частицам сблизиться на такое расстояние, где преобладают силы притяжения – происходит коагуляция. Так как в данном случае причиной коагуляции является увеличение концентрации противоионов, она называется концентрационной коагуляцией.
= 0 (кривая 2). Поэтому ничто не мешает коллоидным частицам сблизиться на такое расстояние, где преобладают силы притяжения – происходит коагуляция. Так как в данном случае причиной коагуляции является увеличение концентрации противоионов, она называется концентрационной коагуляцией.
Нейтрализационная коагуляция происходит при добавлении к золю неиндифферентного электролита. Как отмечалось в разделе 8.4, при этом потенциалопределяющие ионы связываются в малорастворимое соединение, что приводит к уменьшению абсолютных величин термодинамического потенциала, а следовательно, и дзета – пртенциала вплоть до нуля.
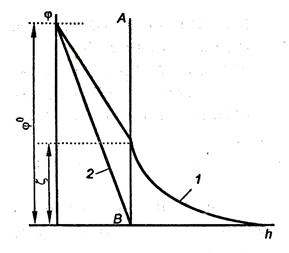
Рис.10.3. Падение потенциала в ДЭС мицеллы хлорида серебра

Рис.10.4. Потенциальная кривая, характеризующая взаимодействие коллоидных частиц хлорида серебра
Если взять в качестве исходного только что рассмотренный золь хлорида серебра, то для нейтрализации потенциалопределяющих ионов Ag+ в золь необходимо ввести, например, хлорид калия. После добавления определенного количества этого неиндифферентного электролита мицелла будет иметь вид:
{(n + m)AgCl}.
В системе не будет ионов, способных адсорбироваться на поверхности частицы AgCl, и поверхность станет электронейтральной. При столкновении таких частиц происходит коагуляция.
Так как причиной коагуляции в данном случае является нейтрализация потенциалопределяющих ионов, такую коагуляцию называют нейтрализационной коагуляцией.
Необходимо отметить, что для полной нейтрализационной коагуляции неиндифферентный электролит должен быть добавлен в строго эквивалентном количестве.
КОАГУЛЯЦИЯ СМЕСЬЮ ЭЛЕКТРОЛИТОВ
Коагуляция смесью электролитов имеет большое практическое значение, так как даже при добавлении к золю одного электролита-коагулянта, в действительности коагуляция происходит, по крайней мере, под влиянием двух электролитов, так как в системе, кроме того, содержится электролит-стабилизатор. Кроме того, в технике для коагуляции часто применяют смесь двух электролитов. Понимание закономерностей взаимного действия электролитов важно также при исследовании воздействия биологически активных ионов на органы и ткани живого организма.
При коагуляции золя смесью двух электролитов возможны три случая (рис.10.5). По оси абсцисс отложена концентрация первого электролита c1, a CK1 – его порог коагуляции. Аналогично по оси ординат отложена концентрация второго электролита с2, а Ск2 – его порог коагуляции.

Рис.10.5. Совместное коагулирующее действие двух электролитов
1. Аддитивное действие электролитов (линия 1). Электролиты действуют как бы независимо один от другого, их суммарное действие складывается из воздействий каждого из электролитов. Если с1' – концентрация первого электролита, то для коагуляции золя концентрация второго электролита должна быть равной с2'. Аддитивность наблюдается обычно при сходстве коагулирующей способности обоих электролитов,
2.Синергизм действия (линия 2). Электролиты как бы способствуют друг другу – для коагуляции их требуется меньше, чем нужно по правилу аддитивности (с2" < с2'). Условия, при которых наблюдается синергизм, сформулировать трудно.
3.Антагонизм действия (линия 3). Электролиты как бы противодействуют друг другу и для коагуляции их следует добавить больше, чем требуется по правилу аддитивности. Антагонизм наблюдается при большом различии в коагулирующем действии электролитов.
Существует несколько теорий, объясняющих явление антагонизма. Одной из его причин может служить химическое взаимодействие между ионами.
Например, для золя AgCl, стабилизированного хлоридом калия, коагулирующим действием обладают катионы. Например, большой коагулирующей способностью обладает четырехзарядный ион тория Th4+. Однако если взять для коагуляции смесь Th(NO3)4 и K2SO4, то коагулирующая способность этой смеси значительно меньше, чем отдельно взятого Тh(NОз)4. Связано это с тем, что в результате химической реакции образуется комплекс:
Th(NO3)4 + 3K2SO4 = K2[Th(SO4)3] + 4KNO3,
и вместо четырехзарядных ионов Th4+ в золе будут находиться однозарядные катионы К+, коагулирующее действие которых значительно слабее (правило Шульце-Гарди).