
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энтропия является мерой потери работоспособности системы вследствие необратимости реальных процессов.
|
|
Потеря работы от необратимости процесса прямо пропорциональна возрастанию энтропии. Влияние необратимости на потерю работы можно оценить количественно. Для этого рассмотрим следующий пример. Пусть имеем изолированную термодинамическую систему, состоящую из ВИТ с температурой T 1, рабочего тела (РТ) и НИТ с температурой Т 2. Максимальная доля теплоты, переданной, от ВИТ к РТ, которая может быть превращена в работу, в идеальном случае определяется кпд обратимого цикла Карно. Если передать от ВИТ теплоту dQ 1, то за цикл получим следующую работу:
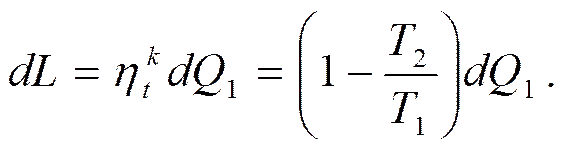
Теплота, отданная НИТ,

Найдем суммарное изменение энтропии системы:

где  - уменьшение энтропии ВИТ вследствие отвода теплоты;
- уменьшение энтропии ВИТ вследствие отвода теплоты;
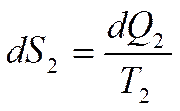 - возрастание энтропии НИТ вследствие подвода теплоты.
- возрастание энтропии НИТ вследствие подвода теплоты.
Как и следовало ожидать, изменение энтропии в обратимом процессе, протекающем в изолированной системе, равно нулю. Найдем изменение энтропии для необратимого процесса.
Допустим, что теплота от ВИТ передается сначала промежуточному теплоносителю с температурой  (например, от продуктов сгорания пару).
(например, от продуктов сгорания пару).
В результате энтропия ВИТ уменьшится на величину  . Энтропия промежуточного теплоносителя увеличится на
. Энтропия промежуточного теплоносителя увеличится на 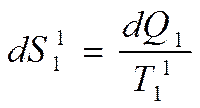 . Так как из-за необратимости теплообмена
. Так как из-за необратимости теплообмена 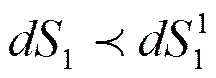 , то энтропия всей системы возрастает
, то энтропия всей системы возрастает
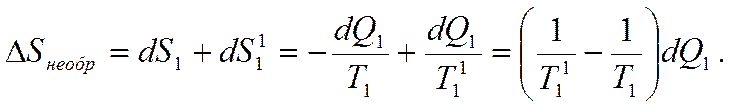
Полезную работу можно получить, осуществляя цикл Карно между промежуточным теплоносителем и НИТ (например, работа пара на лопатках турбины),
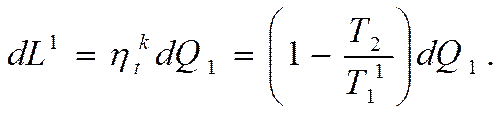
Тогда уменьшение работы в результате необратимого теплообмена будет
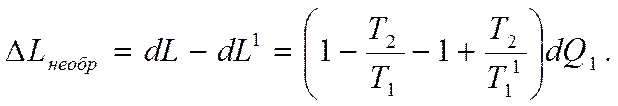
Отсюда получаем

Т.е. уменьшение работы пропорционально возрастанию энтропии при постоянной температуре НИТ. Это уравнение называют уравнением Гюи - Стодолы.
2. Энтропия является мерой работоспособности, технологической эффективности (ценности) теплоты.
Объединяя две известные формулы (3.3) и (3.7) для кпд цикла Карно, можно записать следующее соотношение

или
 (3.15)
(3.15)
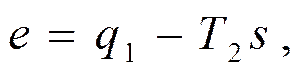
где e= (q 1- q 2) - работоспособность или эксергия теплоты q 1 (подробнее об эксергии см. § 3.11).
Величина эксергии из (3.15) может быть записана в виде
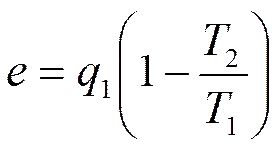
или
 (3.16)
(3.16)
где условно принято s = q 1/ T 1 - удельная энтропия.
Если температура ВИТ равна температуре НИТ, т.е. T 1= T 2, то это соответствует максимальному значению энтропии и величина полезной работы, как следует из формулы (3.16), равна нулю. Таким образом, возрастание энтропии изолированной системы связано с обесцениванием энергии, поэтому энтропию иногда называют также мерой обесценивания энергии.
3. Энтропия есть мера беспорядка, деградации и дезорганизации системы. Если теплота отводится от системы, то энтропия ее уменьшается. Вместе с тем увеличивается упорядоченность системы вследствие уменьшения хаотичности теплового движения молекул и атомов.
В результате всех возможных необратимых изменений система перерождается или деградирует и приходит к следующему состоянию:
а) все тела системы приняли одинаковую температуру;
б) все количество полезной работы превращено в теплоту;
в) концентрации и давления в системе выровнялись;
г) произошло предельное измельчение и равномерное перемешивание
вещества в системе.
В этом случае повод к дальнейшему изменению системы оказывается устраненным. Энтропия достигает своего максимального значения.
Одно из важнейших свойств энтропии состоит в том, что она есть функция некоторых параметров состояния. Аналитически это свойство может быть выражено соотношениями
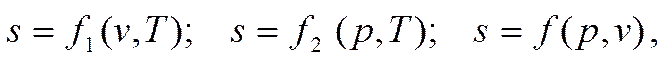
где p, v и T - независимые параметры, определяющие состояние тела. Тогда для полного дифференциала энтропии, например, для случая s = f 1(v, T), можно записать следующее уравнение
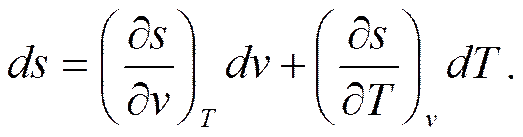
Если параметры состояния даны, то принципиально энтропию можно вычислить с точностью до некоторой постоянной.
Знание точной величины абсолютного значения энтропии необходимо для процессов, протекающих с изменением массы исходных веществ и образованием из них новых (например, при химических реакциях). Эта задача может быть решена с помощью третьего закона термодинамики. Его содержание раскрывает так называемая тепловая теорема Нернста, одним из следствий которой является вывод об отсутствии изменения энтропии при абсолютном нуле температуры
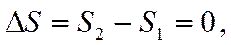 при
при 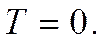
Этот вывод позволил Планку высказать мысль, что константа энтропии для всех систем при абсолютном нуле температуры равна нулю (см. § 13.21)
S 0=0 при T =0.
Данное положение является постулатом Планка. Доказательство этого результата может быть получено, если воспользоваться законом Больцмана о связи энтропии с вероятностью состояния (доказательство приводится в [15], см. также § 3.9)
Важное практическое применение постулата Планка состоит в возможности вычисления абсолютного значения энтропии.
В отдельных задачах энтропию можно рассматривать не как функцию состояния, а как независимый параметр состояния, подобно тому, как давление, температура и удельный объем могут быть и функциями состояния, и независимыми параметрами состояния. Это свойство дает возможность строить диаграммы, где одним из параметров является энтропия. В технике наибольшее распространение получили так называемые Ts и is - диаграммы.