
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Первый закон термодинамики. Энтальпия.
|
|
*Первое начало термодинамики — одно из основных положений термодинамики, являющееся, по существу, законом сохранения энергии в применении к термодинамическим процессам.
1)Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил.
2)Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе и не зависит от способа, которым осуществляется этот переход.
а) Внутренняя энергия изолированной системы постоянна. U=conts, dU=0
б) Все виды энергии переходят друг в друга в строго эквивалентных отношениях
δ Q=du+δ W - работа не является функцией состояния
Теплота, поддерживаемая в системе идет на увеличение внутренней энергии системы и на совершение системой работы δ - не ФС, d - ФС
δ W=pΔ V - Единственный вид механической работы которое рассматривает химическую термодинамику – это работа расширения против сил внешнего давления.
δ Q=dU+ pΔ V
1. Рассмотрим систему при V=const
V=const Δ V=0
δ Q=dU+ (pΔ V)=0
δ Q=dU dU - теплоте, V=const
В системе при V=const теплота приобретает свойства функции состояния Qv- ФС
2. При p=const
dQ = dU+pdV
DQ = DU+pdV
DQ = Q2-Q1 + pV2-pV1 = (U2+pV2)-(U1+pV1) = H2-H1=DH. H=U+pV
Из этого выражения видно, что теплота при постоянном давлении приобретает свойства ФС. Таким образом, если химическая реакция протекает при постоянном
объеме или давлении, то теплота, которая выделяется или поглощается при протекании реакции является ФС
**Энтальпия, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц
Энтальпия – ФС H=U+pV. Характеристическая функция H=U+pV называется энтальпией. Энтальпия имеет размерность энергии (кДж). В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, Δ H < 0), а поглощение системой теплоты соответствует эндотермическому процессу, Δ H > 0.
Рассмотрим несколько случаев:
1. Если δ Q > 0, то это означает, что тепло к системе подводится.
2. Если δ Q < 0, аналогично — тепло отводится.
3. Если δ Q = 0, то систему называют адиабатически изолированной.
Обобщая: в конечном процессе 1→ 2 элементарные количества теплоты могут быть любого знака. Общее количество теплоты, которое мы назвали просто Q — это алгебраическая сумма количеств теплоты, сообщаемых на всех участках этого процесса. В ходе процесса теплота может поступать в систему или уходить из неё разными способами.
При отсутствии работы над системой и потоков энергии-вещества, когда δ A ' = 0, δ Q = 0, dN = 0, выполнение системой работы δ A приводит к тому, что Δ U < 0, и энергия системы U должна убывать. Из ограниченности энергии U как раз и следует невозможность двигателя первого рода, выполняющего бесконечную работу за счёт собственной энергии
Первое начало термодинамики:
а) при изобарном процессе
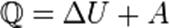
б) при изохорном процессе (A=0)

в) при изотермическом процессе (Δ U = 0)
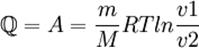
Первый закон (первое начало) термодинамики можно сформулировать так:
«Изменение полной энергии системы в квазистатическом процессе равно количеству теплоты Q, сообщённого системе, в сумме с изменением энергии, связанной с количеством вещества N при химическом потенциале μ, и работы A', совершённой над системой внешними силами и полями, за вычетом работы А, совершённой самой системой против внешних сил»:
Δ U = Q − A + μ Δ N + A '.
Для элементарного количества теплоты δ Q, элементарной работы δ A и малого приращения (полного дифференциала) dU внутренней энергии первый закон термодинамики имеет вид:
dU = δ Q − δ A + μ dN + δ A '.
Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая – работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Важно заметить, что dU и dN являются полными дифференциалами, а δ A и δ Q - нет. Приращение теплоты часто выражают через температуру и приращение энтропии: δ Q = TdS.