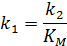Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
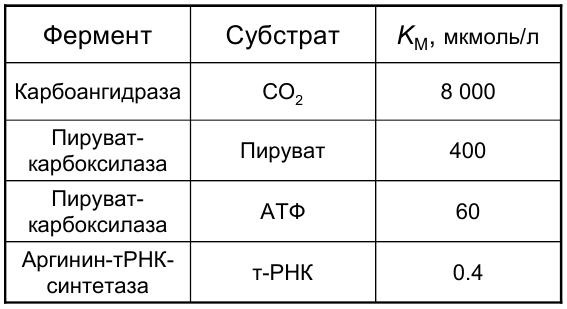
Ферментативный катализ
|
|
Пример односторонней простой реакции первого порядка:
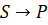
где S – субстрат (исходное вещество); Р - продукт.
В присутствии фермента реакция протекает по механизму Л. Михаэлиса:
k1 k2
S +E ↔ ES → P
k-1
где E – фермент (энзим); ES – фермент-субстратный комплекс. Первая стадия – обратимая, быстрая; вторая – односторонняя, медленная.
Точного аналитического решения не существует, поэтому используется метод стационарных концентраций (Михаэлиса-Ментен). Скорость реакции определяется скоростью медленной стадии:
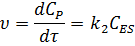
Скорость образования промежуточного вещества:
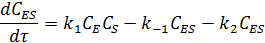
При условиях:
· 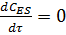 (концентрация фермент-субстратного комплекса стационарна);
(концентрация фермент-субстратного комплекса стационарна);
· 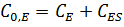 ;
;
· 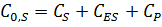 ;
;
· 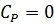 (в начальный момент времени отсутствует продукт);
(в начальный момент времени отсутствует продукт);
·  (начальная концентрация субстрата значительно выше начальной концентрации фермента) это означает, что
(начальная концентрация субстрата значительно выше начальной концентрации фермента) это означает, что  мало и
мало и  .
.
Концентрацию фермент-субстратного комплекса можно выразить уравнением:
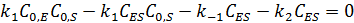
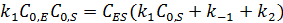
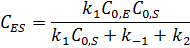
После деления числителя и знаменателя на 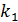 получаем:
получаем:
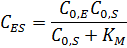
Величина 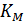 – константа Михаэлиса (решение ИЮПАК) определяется выражением:
– константа Михаэлиса (решение ИЮПАК) определяется выражением:
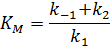
Уравнение скорости образования продукта в начальный момент времени:
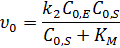
· Если 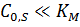 , то можно записать:
, то можно записать:
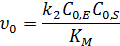
Начальная скорость линейно зависит от концентрации субстрата, порядок по субстрату первый, по ферменту – первый.
· Если  , то получаем:
, то получаем:
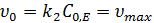
Начальная скорость не зависит от концентрации субстрата, порядок реакции по субстрату нулевой, по ферменту – первый. Скорость реакции достигает максимального значения, когда весь фермент насыщен субстратом. Именно в этих условиях удобно сравнивать скорости различных ферментативных реакций.
Для уравнения начальной скорости реакции можно записать:
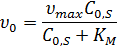
Зависимость скорости ферментативной реакции от времени представлена на рисунке.

Константа Михаэлиса 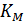 численно равна концентрации субстрата, при которой активность фермента составляет половину максимальной:
численно равна концентрации субстрата, при которой активность фермента составляет половину максимальной:
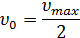
Величина 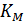 имеет значения порядка 10-2 -10-8 моль/л и не зависит от концентрации фермента, а зависит от температуры, рН среды, активаторов и ингибиторов.
имеет значения порядка 10-2 -10-8 моль/л и не зависит от концентрации фермента, а зависит от температуры, рН среды, активаторов и ингибиторов. 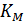 характеризует специфичность фермента по отношению к субстрату (чем меньше
характеризует специфичность фермента по отношению к субстрату (чем меньше 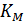 , тем больше специфичность.
, тем больше специфичность.
Если 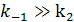 то:
то:
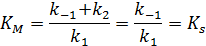
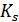 – константа диссоциации фермент-субстратного комплекса, характеризует меру связывания фермента с субстратом,
– константа диссоциации фермент-субстратного комплекса, характеризует меру связывания фермента с субстратом, 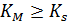 .
.
Для ферментов с известной молекулярной массой и значением 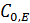 можно рассчитать k2:
можно рассчитать k2:
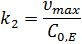
Величина k2 – число оборотов – характеризует активность фермента (чем больше k2, - тем выше активность).
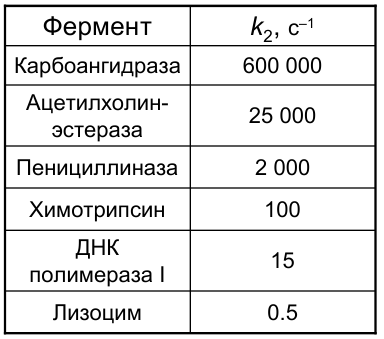
Для простых реакций если  можно рассчитать k1:
можно рассчитать k1: