
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Понятие о порядке реакции по реагенту
|
|
Элементарный акт химической реакции осуществляется в момент столкновения реагирующих частиц. Увеличение концентрации реагентов соответствует увеличению числа частиц в объеме, что приводит к более частым их столкновениям, а следовательно, к увеличению скорости реакции. Количественная зависимость скорости реакции от концентрации выражается основным постулатом химической кинетики, называемым законом действующих масс.
Скорость простой гомогенной реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, численно равные их стехиометрическим коэффициентам.
aA + bB → dD + fF
υ = kca(A)cb(B)
где a и b - стехиометрические коэффициенты реагентов; с(А) и с(В) - молярные концентрации реагентов; k - константа скорости реакции.
Это выражение для скорости реакции является кинетическим уравнением только для простой реакции.
Константа скорости реакции является индивидуальной характеристикой реакции. Значение константы скорости реакции зависит от природы реагирующих веществ, температуры системы и наличия в ней катализатора. Значение k для данных условий реакции не зависит от концентрации реагентов, и поэтому константа скорости остается неизменной в течение реакции и является ее фундаментальным кинетическим параметром.
Значение константы скорости реакции численно равно скорости реакции при концентрациях реагентов, равных 1 моль/л.
Определить константу скорости реакции можно только экспериментальным путем, изучая кинетику этой реакции и составляя ее кинетическое уравнение по полученным данным.
Кинетическое уравнение каждой реакции определяют экспериментально, так как его нельзя предсказать по виду химического уравнения реакции. Поэтому вначале при постоянной температуре экспериментально устанавливают зависимость скорости реакции от концентрации каждого реагента в отдельности, при этом концентрации всех других реагентов должны оставаться постоянными, что обеспечивается обычно большим их избытком в реакционной среде. Для определения концентрации интересующего реагента в любой момент времени используют методы: титрования, потенциометрии, кондуктометрии, хроматографии или другие, выбирая из них такой, чтобы значение измеряемой с помощью этого метода характеристики четко зависело от концентрации данного реагента. По полученным экспериментальным данным составляют кинетическое уравнение для изучаемой реакции:
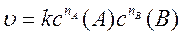
где nA и nB - порядок реакции по реагентам А и В соответственно.
Порядок реакции по реагенту равен показателю степени, в которую надо возвести концентрацию данного реагента в кинетическом уравнении сложной реакции, чтобы вычисленная по этому уравнению скорость была равна скорости, найденной экспериментально.
Таким образом, порядок реакции по реагенту является для данной реакции кинетическим параметром, наряду с константой скорости.
Порядок реакции по реагенту не зависит от стехиометрических коэффициентов в уравнении реакции, а определяется ее механизмом. Если значения порядка реакции по каждому реагенту совпадают со стехиометрическими коэффициентами в химическом уравнении реакции, то это обычно означает, что изучаемая реакция - простая.
Несоответствие между порядком реакции по реагенту и его стехиометрическим коэффициентом в уравнении реакции свидетельствует о сложности и многостадийности данной реакции. Представление о механизме такой реакции можно составить, если предположить, что ее скорость в основном определяется скоростью наиболее медленной, т. е. лимитирующей, стадии. В этом случае кинетическое уравнение, полученное по экспериментальным данным, прежде всего отражает протекание именно лимитирующей стадии, а не всего процесса.
Рассмотрим реакцию термического распада оксида азота (V):
2N2O5 → 4NO2 + O2
Если считать эту реакцию простой, то для скорости этой реакции можно записать такое кинетическое уравнение:
υ = fc2(N2O5)
Однако экспериментальные данные показывают, что скорость этой реакции пропорциональна не второй, а первой степени концентрации оксида азота (V), и в действительности ее кинетическое уравнение имеет вид:
υ = fc1(N2O5)
Это позволяет предположить следующий механизм реакции, включающий две стадии, резко отличающиеся по скорости протекания:
I стадия: N2О5 → N2O3 + О2
II стадия: N2О5 + N2О3 → 4NО2
Только в случае, если скорость I стадии несравненно меньше, чем второй, будет наблюдаться полное согласие с полученными экспериментально кинетическими данными, отраженными в кинетическом уравнении, где порядок реакции по N2O5 равен 1.
Для экспериментального определения значений константы скорости реакции (k) и порядка реакции по реагенту А (пА) необходимо исследовать зависимость скорости этой реакции от концентрации реагента А при условии, что концентрации других реагентов в реакционной смеси будут настолько большими, что практически не будут изменяться в ходе данного эксперимента. Тогда кинетическое уравнение изучаемой реакции будет иметь вид:

Определение порядка реакции nА по компоненту А
 После логарифмирования этого выражения получим уравнение
После логарифмирования этого выражения получим уравнение
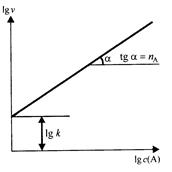
lg υ = lg k + nA lg c(A)
 которое при графическом выражении имеет вид прямой линии, тангенс угла наклона которой к оси lg с(А) равен порядку реакции nА (рис. 5.2). Отрезок, отсекаемый этой прямой на оси lg υ, когда lg с(А) = 0, дает значение lg k. Следовательно, при подобной обработке экспериментальных данных можно определить значения важнейших кинетических параметров реакции - порядка реакции по реагенту и константы скорости данной реакции.
которое при графическом выражении имеет вид прямой линии, тангенс угла наклона которой к оси lg с(А) равен порядку реакции nА (рис. 5.2). Отрезок, отсекаемый этой прямой на оси lg υ, когда lg с(А) = 0, дает значение lg k. Следовательно, при подобной обработке экспериментальных данных можно определить значения важнейших кинетических параметров реакции - порядка реакции по реагенту и константы скорости данной реакции.
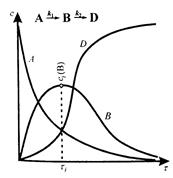
Кинетические кривые изменения концентрации реагентов для двух последовательно протекающих реакций, когда константы скорости реакций k1 и k2 не сильно отличаются друг от друга, имеют сложный вид (рис. 5.3). Кинетическая кривая А соответствует монотонному убыванию концентрации исходного вещества А.
Концентрация промежуточного вещества В проходит через максимум, так как вначале оно накапливается, а потом исчезает. Высота этого максимума сi(B) и время его достижения (τ i) могут быть самыми разными в зависимости от соотношения значений констант k1 и k2. Кривая D характеризует накопление продукта реакции D.