
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химической реакции
|
|
Зная величины констант равновесия при данных условиях и используя стехиометрические соотношения реакции (закон сохранения массы), рассчитывают равновесный состав продуктов по следующей схеме.
1. Пишут уравнение реакции.
2. Пишут под формулами уравнения начальные концентрации исходных веществ (в моль/л). Если начальные концентрации продуктов реакции не оговариваются в условии задачи, они обычно принимаются равными нулю.
А + b В «c С + D
Начальное
состояние [ А ]0 [ В ]0 [ С ]0 0
Число молей
по уравнению 1 b c 1
Изменение
концентраций x b x c x x
Равновесное
состояние [ А ]0 - x [ В ]0 – bx [ С ]0 + c x x
3. Принимают, что в ходе реакции до состояния равновесия прореагировало x моль/л какого-либо вещества. Обычно за x принимают изменение концентрации того реагента, стехиометрический коэффициент при котором в уравнении реакции наименьший, чтобы избежать дробных коэффициентов при неизвестном x. Например, прореагировало x моль/л вещества А.
4. По уравнению реакции определяют изменение концентраций других веществ.
5. Определяют равновесные концентрации веществ. При протекании реакции в прямом направлении до состояния равновесия происходит уменьшение концентраций исходных веществ и увеличение концентраций продуктов реакции.
6. Пишут выражение закона действующих масс. Подставляют в него найденные значения равновесных концентраций.
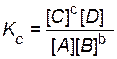 ,
,
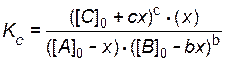 .
.
7. Решают уравнение с одним неизвестным. При этом учитывают, что отрицательный корень не имеет физического смысла, и убыль концентрации исходного вещества не может быть больше величины самой концентрации (начальная концентрация исходного вещества не может быть меньше его остаточной равновесной концентрации).
8. Находят равновесные концентрации.
[ А ] = [ А ]0- x;
[ B ] = [ B ]0 - b x;
[ C ] = [ С ]0 + cx;
[ D ] = x.
Приведенная схема расчета может быть применена также для определения исходных (начальных) молярных концентраций, если известны равновесные концентрации реагентов.