
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Изменение давления
|
|
Повышение давления (уменьшение общего объема) вызывает смещение равновесия в направлении уменьшения общего количества молей газообразных веществ, т.е. в направлении, приводящем к понижению давления.
При уменьшении давления (увеличении общего объема) равновесие смещается в сторону увеличения количества молей газообразных веществ, т.е. в направлении, приводящем к возрастанию давления.
Рассмотрим, в каком направлении сместится равновесие в системе
CO (г) + Cl2 (г) «COCl2 (г),
если при неизменной температуре увеличить давление путем уменьшения объема газовой смеси?
В реакцию вступают 2 моля, а образуется 1 моль газообразных веществ. Прямая реакция при постоянном объеме сопровождается уменьшением давления. Если увеличить общее давление в системе, то согласно принципу Ле Шателье равновесие сместится в сторону прямой реакции.
Это можно доказать расчетами. Скорость прямой реакции равна

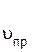 =
= 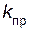 [СО][Сl2],
[СО][Сl2],
скорость обратной реакции равна
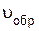 =
= 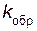 [COCl2].
[COCl2].
При повышении давления объем системы уменьшился, например, в 3 раза. Тогда концентрации всех реагентов увеличатся в 3 раза. При этом скорость прямой реакции увеличивается в 9 раз:
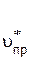 =
=  (3 [CO]) × (3 [Cl2]) =
(3 [CO]) × (3 [Cl2]) =  × 32 [CO][Cl2] = 9
× 32 [CO][Cl2] = 9 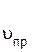 .
.
Скорость обратной реакции увеличивается только в 3 раза:
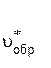 =
= 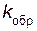 (3[СОCl2]) = 3
(3[СОCl2]) = 3 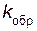 [СОCl2] = 3
[СОCl2] = 3 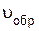 .
.
Таким образом, равновесие этой реакции будет смещаться в сторону накопления СОCl2 в системе до тех пор, пока не установится вновь состояние химического равновесия.
Для реакций, протекающих без изменения числа молей газообразных веществ, изменение давления (или общего объема) не влияет на химическое равновесие и равновесный состав продуктов.
Для реакции
H2 (г) + I2 (г) «2 HI (г)
количество молей газообразных веществ слева и справа от знака равновесия равно. При изменении давления скорости прямой и обратной реакций изменяются одинаково, а их отношение будет оставаться неизменным. В этом случае изменение давления не влияет на положение равновесия.
Рассмотрим влияние разбавления реагирующей смеси инертным газом на химическое равновесие.
1. Если разбавление ведется при постоянных давлении и температуре (изобарно-изотермический процесс), объем системы при накачивании инертного газа увеличивается (он пропорционален количеству вещества n газов, 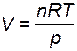 . Следовательно, молярные концентрации
. Следовательно, молярные концентрации 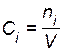 и парциальные давления
и парциальные давления 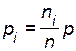 исходных веществ и продуктов реакции уменьшаются (
исходных веществ и продуктов реакции уменьшаются (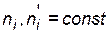 ;
; 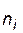 – число молей i - го исходного вещества,
– число молей i - го исходного вещества, 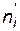 – число молей i - го продукта реакции). Создается эффект уменьшения общего давления, ведущий к смещению равновесия в соответствующем направлении.
– число молей i - го продукта реакции). Создается эффект уменьшения общего давления, ведущий к смещению равновесия в соответствующем направлении.
2. Если разбавление осуществляется при постоянных объеме и температуре (изохорно-изотермический процесс), то при накачивании инертного газа, например, в автоклав, общее давление возрастает пропорционально увеличению количества вещества газов в системе  . При
. При 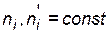 молярные концентрации
молярные концентрации 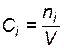 и парциальные давления
и парциальные давления 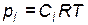
 исходных веществ и продуктов сохраняются постоянными. В этом случае разбавление инертным газом не влияет на химическое равновесие.
исходных веществ и продуктов сохраняются постоянными. В этом случае разбавление инертным газом не влияет на химическое равновесие.