
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Определение констант ионизации слабых электролитов
|
|
1.4.2.1. Определение констант ионизации слабых электролитов методом рН-метрии
В этом методе можно использовать различные индикаторные электроды: хингидронный, стеклянный, водородный. Чаще всего такое определение проводят со стеклянным индикаторным электродом, и хлорсеребряным электродом сравнения, работая на специальном приборе − рН-метре. В этом приборе измеренная компенсационным методом ЭДС электрохимической цепи преобразуется в показания шкалы рН.
Ионизация слабой одноосновной кислоты протекает по уравнению
H2O + H2O = H3O+ + OH- x 1
HA + H2O = H3O+ + A- x 2
Балансовые уравнения имеют вид:
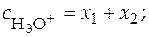
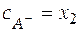 ;
; 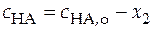 .
.
Константа ионизации слабой кислоты находится по уравнению
 . (25)
. (25)
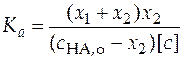 .
.
Этот метод приближенный, в нем не учитывается реакция автопротолиза воды, а также значения средних ионных коэффициентов активности. Как показывают расчеты такое допущение возможно, если исследовать кислоты, константы ионизации которых лежат в диапазоне 1∙ 10− 4 − 1∙ 10− 6 ([ с ]= 1 моль/л).
Тогда уравнение (25) можно представить как
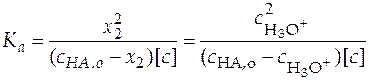 . (26)
. (26)
Поскольку кислота слабая, то можно предположить, что концентрация ионов гидроксония гораздо меньше, чем аналитическая концентрация слабой кислоты  , тогда уравнение (26) преобразуется к виду
, тогда уравнение (26) преобразуется к виду
 . (27)
. (27)
Прологарифмировав уравнение (27) и выразив величины в него входящие как функцию рН раствора, получим
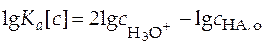 .
. 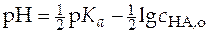 . (28)
. (28)
Уравнение (28) линейно в координатах рН − логарифм концентрации кислоты. Свободный член этого уравнения связан с константой ионизации. При экспериментальном определении величины константы ионизации методом рН-метрии необходимо представить экспериментальные данные в виде графической зависимости 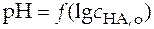 и по отрезку, отсекаемому на оси ординат определить величину константы ионизации (рис.8).
и по отрезку, отсекаемому на оси ординат определить величину константы ионизации (рис.8).

Рис. 8
Ионизация слабого основанияможет быть выражена уравнением
H2O + H2O = H3O+ + OH- x 1
B + H2O = BH+ + OH-. x 2
Рассуждая аналогично примеру со слабой кислотой, получим для слабого основания зависимость величины рН от логарифма концентрации электролита

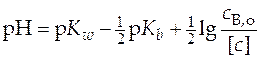 . (29)
. (29)
Графическое построение этой зависимости (29) позволит определить величину константы ионизации слабого основания (рис.9)

Рис. 9
1.4.2.2.Определение константы ионизации слабой кислоты
методом измерения ЭДС
Для определения константы ионизации слабой кислоты НА собирают гальванический элемент без переноса, состоящий из водородного и хлорсеребряного электродов в растворе сложного состава.
В растворе находятся слабая кислота  , растворимая и полностью диссоциирующая соль этой кислоты, например,
, растворимая и полностью диссоциирующая соль этой кислоты, например, 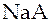 и хлорид натрия
и хлорид натрия 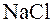 . Обозначим аналитические концентрации слабой кислоты
. Обозначим аналитические концентрации слабой кислоты  ; концентрации солей
; концентрации солей 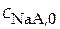 ;
; 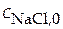 .
.
Схема такого элемента
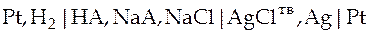
На электродах протекают следующие реакции:
на правом электроде: 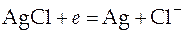 ,
,
на левом: 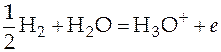 .
.
Суммарная реакция в гальваническом элементе
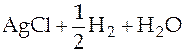 ⇄
⇄ 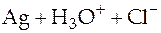 .
.
Величина ЭДС такого гальванического элемента найдется по формуле:
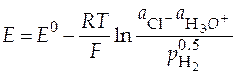 . (30)
. (30)
Давление в водородном электроде равно 1 атм, следовательно уравнение (30) переходит к виду:
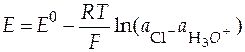 . (31)
. (31)
В водном растворе электролита протекают следующие реакции:
H2O + H2O = H3O+ + OH- x 1
HA + H2O = H3O+ + A- x 2
NaA = Na+ + A− x 3 = 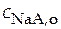
NaCl = Na+ + Cl− x 4 = 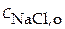
Константа ионизации слабой кислоты выражается уравнением
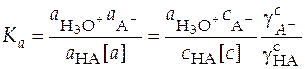 . (32)
. (32)
Балансовые уравнения имеют вид:
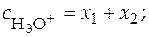
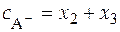 ;
; 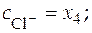
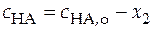 .
.
Можно допустить, что x 1 < < x 2; x 1 < < x 3 и x 1 < < x 4.
Поскольку исследуемая кислота слабая, то можно также допустить в первом приближении, что x 2 < < x 3; x 2 < <  . Иными словами равновесная концентрация кислоты НА практически не будет отличаться от начальной, аналитической, так как кислота слабая и концентрацией ионов водорода (плотностью глубины второй реакции x2) в уравнении материального баланса можно пренебречь:
. Иными словами равновесная концентрация кислоты НА практически не будет отличаться от начальной, аналитической, так как кислота слабая и концентрацией ионов водорода (плотностью глубины второй реакции x2) в уравнении материального баланса можно пренебречь:

 .
.
Равновесная концентрация аниона может быть приравнена к аналитической концентрации растворимой соли, т.е.
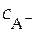 ≈
≈ 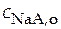 .
.
Тогда выражение константы ионизации будет следующим
Активность хлоридных ионов связана с концентрацией хлористого натрия
 . (33)
. (33)
Выразим из (32) активность ионов водорода
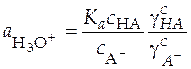 (34)
(34)
и подставим полученные выражения в уравнение (31)
 . (35)
. (35)
Сгруппируем слагаемые уравнения удобным образом для построения графика:
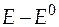 +
+ 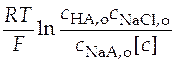 =
= 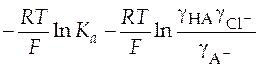 . (36)
. (36)
То, что стоит в уравнении (36) слева находится расчетом из данных эксперимента и справочных данных. Обозначим левую часть  . Строим график зависимости левой части уравнения от корня квадратного ионной силы раствора (рис.10).
. Строим график зависимости левой части уравнения от корня квадратного ионной силы раствора (рис.10).
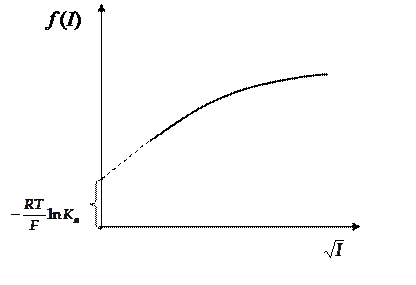
Рис.10
Экстраполируем затем полученную зависимость на нулевую ионную силу раствора, понимая, что при этом коэффициенты активности стремятся к единице и отрезок, отсекаемый на оси ординат будет связан с константой ионизации слабой кислоты.
В следующем приближении после нахождения величины константы ионизации оценивают концентрацию ионов гидроксония по формуле
 .
.
Затем вычисляют концентрации аниона и нейтральной формы кислоты по формулам:
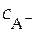 =
= 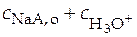 ;
;  =
=  .
.
Эти уточненные значения подставляют в уравнение (36). В левой части будем иметь
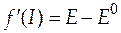 +
+ 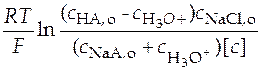 . (37)
. (37)
Повторяем определение константы ионизации методом экстраполяции функции  к нулевой ионной силе. Как утверждают авторы [7], чем меньше константа ионизации, чем меньшее число приближений приводит к окончательному результату.
к нулевой ионной силе. Как утверждают авторы [7], чем меньше константа ионизации, чем меньшее число приближений приводит к окончательному результату.
1.4.2.3.Определение константы кислотности методом
потенциометрического титрования
Для проведения потенциометрического титрования необходимо составить гальванический элемент, в котором потенциал одного из электродов должен зависеть от активности ионов исследуемого вещества или титрующего реагента. Этот электрод называется индикаторным. Второй электрод в элементе служит электродом сравнения. При добавлении к электролиту индикаторного электрода другого раствора происходит химическая реакция, в результате которой изменяется активность потенциалобразующих ионов, а следовательно, и потенциал индикаторного электрода, и ЭДС элемента. При потенциометрическом титровании могут использоваться реакции нейтрализации, осаждения, комплексообразования, а также окислительно-восста-новительные реакции. Химические реакции, используемые для потенциометрического титрования, должны удовлетворять следующим требованиям: протекать достаточно быстро, только в одном направлении и возможно полнее.
При реакциях нейтрализации в качестве индикаторных электродов применяются электроды, потенциал которых является функцией рН раствора (водородный, хингидронный, стеклянный). Выбор электрода зависит от условий титрования, наличия в растворе загрязнений, наличия окислителей или восстановителей, интервала рН при титровании. Электродом сравнения может служить любой электрод, потенциал которого остается постоянным в ходе титрования. Обычно в качестве электродов сравнения используют электроды второго рода - каломельный или хлорсеребряный.
Потенциометрическое титрование используется для нахождения таких величин, как произведение растворимости малорастворимых соединений, констант ионизации слабых кислот и оснований, констант нестойкости комплексных соединений и констант равновесия окислительно− восстановительных реакций.
Поскольку потенциометрическое титрование проводят обычно в разбавленных растворах, то во всех уравнениях, характеризующих изменение потенциала и ЭДС элемента в ходе титрования, можно принять коэффициенты активности равными единице.
Для определения  надо измерить концентрацию ионов гидроксония в растворе с известной концентрацией кислоты. В качестве индикаторного электрода можно использовать стеклянный или хингидронный электрод, например Ag | AgCl | KCl || H3O+, нас.х.г |Pt.
надо измерить концентрацию ионов гидроксония в растворе с известной концентрацией кислоты. В качестве индикаторного электрода можно использовать стеклянный или хингидронный электрод, например Ag | AgCl | KCl || H3O+, нас.х.г |Pt.
Для получения более точных результатов проводят титрование раствора слабой кислоты раствором NaOH, в ходе титрования измеряют величину ЭДС элемента и рассчитывают рН.
В системе протекают следующие реакции:
H2O + H2O = H3O+ + OH- x 1
HA + H2O = H3O+ + A- x 2
H3O+ + NaOH = 2 H2O + Na x 3
Можно допустить, что x 1 < < x 2 и x 1 < < x 3, при этом балансовые уравнения имеют вид:
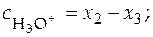
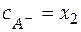 ;
; 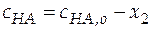 .
.
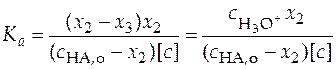 . (38)
. (38)
Из уравнения (38) следует, что для определения константы ионизации слабой кислоты необходимо измерить концентрацию ионов гидроксония и рассчитать плотность глубины второй реакции.
Как было показано ранее в уравнении (24),
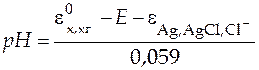
 , (39)
, (39)
 ,
,
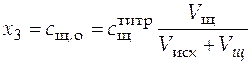 . (40)
. (40)
Из уравнения (39) и (40) следует
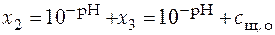 ,
,
 . (41)
. (41)
1. Если  , то можно не учитывать разведение.
, то можно не учитывать разведение.
Тогда
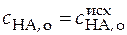 ;
;  .
.
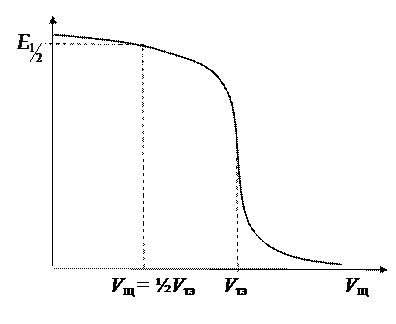
Рис.11
2. Для очень слабой кислоты можно допустить, что
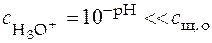 , при этом уравнение (41) примет вид
, при этом уравнение (41) примет вид
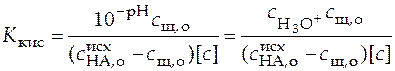 ,
,
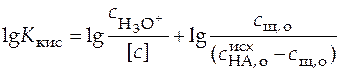 .
.
При 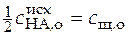 , т.е. в точке, когда оттитрована половина кислоты,
, т.е. в точке, когда оттитрована половина кислоты,
 ,
,
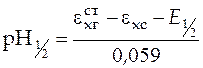 ,
, 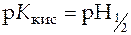 .
.
При принятых допущениях для определения константы ионизации слабой кислоты необходимо:
1) измерить ЭДС исследуемого элемента в годе титрования кислоты щелочью; 2) построить кривую титрования (рис.11);
3) найти на кривой титрования точку эквивалентности (точку перегиба) и значение ЭДС, соответствующее нейтрализации кислоты наполовину (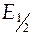 при V щ= ½ V тэ).
при V щ= ½ V тэ).