
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Дата: 30.04.13
|
|
Пропись № 1 Rp: Inf.Herbae Leonuri ex 12, 0-200 ml
Natrii bromidi 3, 0
Natrii barbital 2, 0
Описание: Мутная жидкость с запахом мяты и валерианы. Общий объем 200 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ:
Натрия бромид. К 0, 5 мл ЛФ прибавляют 5-6 капель разведенной кислоты азотной и 2-3 капли раствора серебра нитрата. Образуется светло-желтый творожистый осадок.
NaBr + AgNO3 → AgBr↓ светло-желт. + NaNO3
Барбитал натрия. Реакция комплексообразования с нитратом кобальта в спирто-водной среде (для предотвращения гидролиза), в присутствии хлорида кальция, который играет роль буфера.
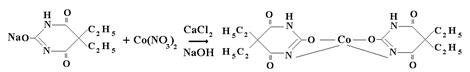 |
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ:
Барбитал натрий. Количественное содержание в растворе определяют методом нейтрализации (алкалиметрии) в неводном растворителе. Этот метод основан на образовании нейтрального продукта под действием стандартного раствора натрия гидроксида.
К 1 мл ЛФ, прибавляют 1 мл этанола и 2 капли тимолфталеина и титруют 0, 1М раствором натрия гидроксида до голубого окрашивания.
Т = 0, 1*232, 0/1000 = 0, 0232г/мл
Vтеор. = 0, 005/0, 0232 = 0, 21
На титрование ушло 0, 22мл 0, 1М раствора натрия гидроксида, соответственно содержание исследуемого вещества в граммах равно:
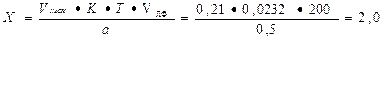 |
Расчет отклонения: Отн.отклонение: 0%
(по П №305 допустимо 4%).
Натрия бромид (аргентометрически методом Мора). Метод основан на способности натрия бромида реагировать с серебра нитратом с образованием серебра хлорида.
К 0, 5 мл ЛФ прибавляют 1 каплю хромата калия и титруют 0, 1 моль/л р-ром серебра нитрата до оранжево-желтого цвета. 1мл 0, 1 моль/л серебра нитрата соответствует 0, 01029 натрия бромида.
NaBr + AgNO3 → AgBr↓ бел. + NaNO3
В т.к.т. 2 AgNO3 + K2CrO4 → Ag2CrO4↓ Кирп. красн + 2KNO3
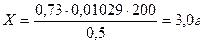 f = 1
f = 1
Т = 0, 1*102, 9/1000 = 0, 01029
Vтеор. = 0, 0075/0, 01029 = 0, 73
Расчет отклонения: Отн.отклонение: 0%
(по П №305 допустимо 5%).
Заключение: Данная лекарственная форма приготовлена удовлетворительно.
Пропись № 2 Rp: Sol. Acidi aminocapronici 5% - 100 ml
Раствор кислоты аминокапроновой 5%-100 мл
Описание: Бесцветная прозрачная жидкость, без запаха, без механических примесей. Общий объем – 100 мл.
ОПРЕДЛЕНИЕ ПОДЛИННОСТИ: см.пропись №1 за 11.04.13г.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: (кислотно-основное титрование в лед.CH3COOH). См.пропись №1 за 17.04.08г.
f=1 T = 0, 1*103/1000 = 0, 0103 г/мл Vтеор. = 0, 05/0, 0103 = 4, 85 мл
 Абс.ошибка: 5, 0– 4, 95= 0, 05;
Абс.ошибка: 5, 0– 4, 95= 0, 05;
Относит.ошибка: 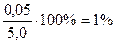
Ошибка не превышает допустимое приказом № 305 (3%).
Заключение: Данная лекарственная форма приготовлена удовлетворительно.