
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
II стадия СЛМР
|
|
II стадия СЛМР называется дальнейшее поддержание жизни. Эта стадия начинается тогда, когда появляется возможность усложнить и, тем самым, сделать более эффективными приемы СЛМР. Заканчивается II стадия СЛМР сразу, как только восстановится самостоятельное эффективное кровообращение (хотя еще неадекватное), то есть появится первая функция, которую уже не надо замещать (протезировать), а которой надо управлять (то есть заниматься ИТ). Этапы II стадии СЛМР могут чередоваться и переплетаться в отличие от описанной ниже последовательности, но в целях улучшения понимания и построения в дальнейшем лечебной тактики они будут изложены по классической схеме.
Этап D
Этот этап весьма обширен и включает в себя продолжение ИВЛ и ИК, введение медикаментов и определение газов крови с кислотно-основным состоянием (КОС).
ИВЛ на II стадии СЛМР приобретает ряд особенностей. Прежде всего, она перестает быть экспираторной, и легкие пациента вентилируются, как минимум, атмосферным воздухом, а то и кислородно-воздушной смесью или даже чистым кислородом (кратковременно). ИВЛ на II стадии проводится ручным или автоматическим способом.
Ручная ИВЛ (РИВЛ) осуществляется с помощью дыхательного мешка или дыхательного меха, которые сжимаются рукой члена реанимационной бригады. Дыхательный мех отличается от дыхательного мешка тем, что мех можно активно растягивать, так как он представляет собой полый гофрированный цилиндр с рукояткой, с помощью которой и осуществляется растяжение. Дыхательный мешок же расправляется пассивно или под давлением кислорода из баллона или благодаря эластическим свойствам стенки мешка. Автоматическая ИВЛ (АИВЛ) обеспечивается специальными дыхательными аппаратами, которые называются респираторами (в зарубежной литературе — вентиляторами или сервовентиляторами). Респираторы освобождают руки и мозг реаниматолога для решения более серьезных проблем.
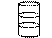
Для обеспечения эффективной ИВЛ, как и на I стадии, нужно определенным способом соединить источник ИВЛ с легкими пациента. Способы этого соединения принято разделять на 3 группы: неинвазивные, условно инвазивные и инвазивные. Степень инвазивности определяется расположением используемого приспособления по отношению к гортани (рис. 5).
Если приспособление не достигает гортани, то способ будет неинвазивным, если оно располагается на уровне гортани — условно инвазивным, если же ниже гортани и/или требуется рассечение или прокалывание кожи с подлежащими тканями — инвазивным.

| Неинвазивные |

| Условно инвазивные |
| Инвазивные |
| Рис. 5. Методы соединения источника ИВЛ с дыхательными путями больного. |
К неинвазивным способам относят применение воздуховода и лицевой маски, часто их используют одновременно. Воздуховод не дает корню языка закрывать вход в гортань, поддерживая проходимость дыхательных путей. Проведение ИВЛ только через воздуховод представляется проблематичным. Умелое использование маски может обеспечить неплохую герметичность дыхательного контура с возможностью проведения недлительной ИВЛ.
Использование ларингеальной маски относится к условно инвазивным способам соединения источника ИВЛ с легкими пациента. Принципиально она устроена так же, как лицевая, только меньше по размерам и имеет отходящую от нее термопластическую[2] трубку. При определенном навыке она достаточно легко вводится через полость рта, достигает входа в гортань и плотно его обхватывает, создавая неплохую герметичность дыхательного контура и обеспечивает возможность проведения ИВЛ в течение нескольких часов. Обычно используется при общих анестезиях с ИВЛ (эндотрахеальных наркозах).
Самым распространенным инвазивным способом является интубация трахеи через рот (чаще) или нос (реже) специальной термопластической эндотрахеальной трубкой с раздувной манжеткой. Эндотрахеальная интубация создает максимально возможную герметизацию дыхательного контура с изоляцией его от ЖКТ и обеспечивает возможность длительной (до 1 недели) ИВЛ. Интубация трахеи осуществляется в подавляющем большинстве случаев под контролем прямой ларингоскопии (ПЛС) с помощью ларингоскопа. После введения трубки в трахею раздувают манжетку и вводят в желудок зонд для его декомпрессии и снижения риска регургитации желудочного содержимого с последующей его аспирацией. Этот риск во время интубации снижают также с помощью приема Селика (нажатие на перстневидный хрящ, в результате чего пищевод сдавливается между хрящом и позвоночником).
Интубации трахеи обычно (особенно, если речь не идет о клинической смерти) предшествует премедикация, призванная снизить рефлексы из зоны гортани и седировать больного. Как минимум, необходимо ввести атропин и димедрол. Интубацию можно осуществлять на спонтанном дыхании, если оно сохранено, или с применением миорелаксантов, что облегчает введение трубки благодаря полному расслаблению мышц гортани, в том числе — голосовых связок.
Еще одним инвазивным способом соединения источника ИВЛ с легкими пациента является трахеостомия. В практике ИТ эта операция всегда является плановой и производится обычно у пациентов, нуждающихся в длительной (более 1 недели) ИВЛ. Дело в том, что эндотрахеальная трубка может находиться в трахее не более 1 недели, в течение которой ее надо хотя бы однажды (через 3-4 дня) сменить. Это связано с тем, что трубка нарушает кровообращение в стенке трахеи и голосовых связках в месте непосредственного контакта, что чревато пролежнями и даже трахеальными свищами. Кроме того, даже при самом тщательном уходе и массивной антибиотикотерапии после интубации трахеи на 3‑ и-4‑ е сутки развивается гнойный трахеобронхит из-за нарушения естественного механизма дренирования мокроты (кашель возможен только при смыкании голосовой щели), а эндотрахеальная трубка не позволяет осуществлять длительную адекватную санацию трахеобронхиального дерева (ТБД) при большом количестве мокроты. Все выше названные проблемы помогает решить трахеостомия с введением в трахеостомическое отверстие специальной канюли, состоящей из постоянной внешней и сменной внутренней частей. Внутреннюю часть периодически удаляют и очищают от сгустков мокроты, затем стерилизуют, а на это время устанавливают запасную внутреннюю часть.
При невозможности в ургентном порядке обеспечить проходимость дыхательных путей никакими из выше перечисленных способов прибегают к коникотомии — рассечению lig. conicum с введением в отверстие «подручной» трубки (авторучка, трубка фонендоскопа и т.п.). В дальнейшем осуществляют переход к другому способу.
Теперь нетрудно видеть преимущества и недостатки различных способов соединения дыхательных путей пациента с источником ИВЛ. Неинвазивные способы, несомненно, просты и быстро осуществляются, требуют минимальной подготовки. Однако эти способы не обеспечивают хорошей герметизации дыхательного контура и, что самое главное, не изолируют дыхательные пути от пищеварительного тракта. Из-за этого во время ИВЛ воздух может попасть в желудок, повысить там давление, в результате чего может произойти регургитация содержимого желудка с последующей его аспирацией. Инвазивные способы сложнее в выполнении, требуют серьезной подготовки, но они обеспечивают максимально возможные герметичность дыхательного контура и изоляцию дыхательных путей от ЖКТ. Недостатки этих способов, указанные выше, не могут снизить их ценность, но помнить об этих недостатках, несомненно, следует.
На этапе D продолжается и ИК. Если ИК проводится на фоне РИВЛ, то соотношение искусственных вдохов и компрессий такое же, как и на I стадии СЛМР. Если же ИВЛ автоматическая (что бывает чаще), массаж сердца проводят, не сообразуясь с работой респиратора и осуществляют компрессии с постоянной частотой 100 мин‑ 1, частота АИВЛ составляет 10 мин‑ 1. Рекомендация не синхронизировать АИВЛ и ИК связана с тем, что респиратор «железный», сильный и не знает усталости. Кроме того, даже если компрессия грудной клетки совпадет с искусственным аппаратным вдохом, последствия будут только положительные. Это можно понять, если вспомнить, что при закрытом массаже сердца работает механизм грудного насоса. В случае совпадения компрессии извне с компрессией изнутри (искусственный вдох), ударный объем заметно увеличится, а также возрастет коронарное перфузионное давление. При РИВЛ и, тем более, ЭИВЛ, такой метод сочетания ИВЛ с ИК невозможен.
Существует также несколько специальных методов ИК, которые можно применить на II стадии.
Использование кардиопомпы, или кардиопампа (от англ. cardiopump). Кардиопамп представляет собой цилиндр с ручками по бокам (как у кастрюли) и присоской на дне. Вместо рук на грудину накладывают этот инструмент и с его помощью проводят массаж сердца. Присоска позволяет в момент искусственной диастолы растягивать грудную клетку, что позволяет увеличить приток крови к сердцу, а, следовательно, и ударный объем.
Вставленная абдоминальная компрессия (ВАК). Между искусственными систолами вторым реаниматором производится компрессия брюшной полости. Это улучшает кровоснабжение миокарда и головного мозга. Как известно, миокард в обычных условиях в основном кровоснабжается в диастолу.
Кашлевая аутореанимация (КАР). Метод обычно используется хроническими кардиологическими больными, научившимися предсказывать скорое наступление у них аритмии вплоть до ОЭК. В этой ситуации больной начинает кашлять («КАРкать»), используя тот факт, что при кашле есть фаза значительного повышения внутригрудного давления, то есть запускается механизм грудного насоса. Такой метод позволяет выиграть время, дать сигнал медперсоналу и поддержать эффективное кровообращение до принятия радикальных мер.
Введение медикаментов. На этапе D начинается введение медикаментов. Основными медикаментами, которые вводятся на II стадии, являются адреналин, атропин, хлорид кальция, лидокаин (все чаще вместо него используется кордарон), гидрокарбонат натрия NaHCO3 (обычная пищевая сода), антигипоксанты и инфузионные среды.
Адреналин является a-, b-, d-адреномиметиком, то есть повышает сократительную способность миокарда (b1-эффект), обеспечивает тонус сосудов-сопротивлений (a-эффект), расширяет почечные сосуды (d-эффект) и бронхи (b2-эффект). Эти эффекты и определили главенствующую роль этого препарата при СЛМР. Рекомендуемые дозы адреналина весьма разнятся в различных руководствах. Обычно начальная доза составляет 1-3 мг (некоторые авторы рекомендуют до 15 мг!, однако следует помнить, что большие дозы адреналина значительно повышают потребление кислорода), которая вводится повторно каждые 2-3 минуты, так как адреналин, являясь эндогенным медиатором, быстро разлагается моноаминооксидазой.
Атропин является м-холиноблокатором, угнетая активность ПСНС и улучшая внутрисердечную проводимость. Доза атропина составляет 3 мг, повторные введения не требуются, так как в организме не имеется специфического фермента, разлагающего это чужеродное для организма вещество, вследствие чего атропин может находиться в организме до 2-4 часов. При асистолии и резистентной к атропину брадикардии вводят эуфиллин (5 мг/кг).
Хлорид кальция (CaCl2) в настоящее время не является препаратом, применяемым во время СЛМР во всех случаях. Показаниями для его применения служат:
1) подозрение или уверенность в гипокальциемии;
2) подозрение или уверенность в гиперкалиемии;
3) подозрение или уверенность в передозировке блокаторов кальциевых каналов.
Доза хлорида кальция обычно составляет 10 мл 10% раствора.
Сульфат магния (MgSO4) вводится при гипомагниемии в дозе 8 ммоль (4 мл 50% раствора).
Лидокаин относится к антиаритмическим препаратам I класса, I-B группе. Препараты этой группы не оказывают существенного влияния на внутрисердечную проводимость и длительность комплекса QRS и повышают порог фибрилляции желудочков (ФЖ). Вводится при ФЖ в начальной дозе 1-2 мг/кг (не больше 3 мг/кг/час, болюсно можно ввести 50 мг).
Последние исследования с применением методов доказательной медицины показали более высокую эффективность кордарона (амиодарона) не только в отношении купирования ФЖ, но и в плане выживаемости пациентов. Кордарон относится (несколько условно) к III классу антиаритмических препаратов, которые блокируют калиевые каналы и увеличивают продолжительность потенциала действия. Начальная доза составляет 300 мг в 100-200 мл 5% раствора глюкозы (скорость введения 15 мг/мин), затем 150 мг (1→ 0, 5 мг/мин), в дальнейшем — 900 мг в сутки.
Гидрокарбонат натрия. Необходимость его введения обусловлена тем, что во время отсутствия кровообращения и, следовательно, отсутствия снабжения тканей кислородом окисление в них начинает идти по анаэробному пути с накоплением молочной кислоты (лактата). Для нейтрализации кислых продуктов и используется NaHCO3. Однако этот препарат должен вводиться с соблюдением определенных правил. Дело в том, что ацидоз развивается в тканях, а поскольку периферическое кровообращение отсутствует, кислые продукты в кровоток не попадают. Введение соды в это время бессмысленно и даже вредно, так как приведет лишь к алкалозу плазмы. Периферическое кровообращение начинает восстанавливаться только через 5-10 минут после восстановления эффективного кровообращения (ЭК) или через 20 минут после начала затянувшейся СЛМР. В это время и следует начинать введение гидрокарбоната натрия в дозе 50 ммоль.
Антигипоксанты. Их роль описана выше. Здесь отметим лишь то, что введение барбитуратов крайне нежелательно, так как среди их побочных эффектов имеется свойство угнетать сократительную способность миокарда и снижать тонус сосудов, что, понятно, при СЛМР недопустимо.
Инфузионная терапия. Инфузионные среды являются как средами для разведения других лекарственных препаратов, так и средствами восполнения дефицита ОЦК, о чем речь пойдет ниже (в разделах, касающихся острой недостаточности кровообращения и водно-солевого обмена).
Пути введения медикаментов. В настоящее время рекомендуют два пути введения лекарственных препаратов во время СЛМР.
Первый путь — через центральные вены (в подавляющем большинстве случаев — через верхнюю полую вену). Введение через периферические вены обычно неэффективно, поскольку, как сказано выше, периферическое кровообращение во время СЛМР отсутствует или резко нарушено. Чтобы иметь возможность вводить медикаменты в верхнюю полую вену, необходимо ее катетеризировать. Чаще всего катетер в v. cava superior вводится через v. subclavia или v. jugularis interna путем пункционной методики Seldinger’а. Возможно и использование других вен, например v. basilica или cephalica путем венесекции. Важно, чтобы катетер достигал верхней полой вены и его кончик располагался в 2-3 см над правым предсердием.
Второй путь — внутрилегочный, или эндотрахеальный. Им пользуются, пока не установлен внутривенный катетер. Обоснованием этого пути является огромная площадь всасывающей альвеолярной поверхности (по разным данным — от 80 до 150 м2). Это путь «нащупали» и наркоманы; как известно, они бывают «инъекционные», а бывают курящие. Курильщики табака также могут подтвердить, что эффект введения никотина таким путем наступает чрезвычайно быстро, практически, как при внутривенном введении. При эндотрахеальном введении дозы препаратов должны быть в 2-3 раза больше, чем указаны выше. Из перечисленных препаратов эндотрахеально можно вводить адреналин, атропин и лидокаин. Остальные препараты следует вводить внутривенно, однако они и не являются препаратами первой очереди.
Эндотрахеальное введение осуществляется через эндотрахеальную трубку, если она уже введена в трахею, в противном случае — путем пункции lig. conicum.
Применявшийся ранее внутрисердечный путь введения в настоящее время не приветствуется из-за возможности травматического повреждения миокарда и других органов грудной клетки (ОГК) и немалой вероятности введения препаратов непосредственно в миокард, а не его полость. К этому пути введения рекомендуется прибегать лишь при невозможности использовать внутривенный (не установлен катетер в полую вену) или внутрилегочный (повреждения, гнойные изменения в области пункции lig. conicum у незаинтубированного больного.
На этапе D контролируется газовый состав крови и КОС, о которых речь пойдет в соответствующих разделах.
Этап E
На этом этапе диагностируется вид остановки сердца, приведший к ОЭК. Различают 3 вида остановки сердца.
Фибрилляция. Это наиболее частый вид остановки сердца, обусловленный несогласованным сокращением отдельных мышечных волокон, результирующая сила которых близка к 0. На ЭКГ наблюдается соответствующая картина.
Асистолия. Встречается в 10-15% случаев остановки сердца. Асистолия — полное отсутствие механической и электрической активности сердца. На ЭКГ регистрируется изолиния.
Электромеханическая диссоциация (ЭМД) представляет собой вариант асистолии, при которой на ЭКГ регистрируется определенная электрическая активность (чаще всего — идиовентрикулярный ритм). Другими словами, ЭМД — разобщение между электрической и механической активностью миокарда, когда он настолько истощен, что не реагирует на импульсы собственной проводящей системы.
Этап F
На этом этапе проводится лечение того вида остановки сердца, который был диагностирован на предыдущем этапе.
При асистолии и ЭМД (на фоне продолжающихся ИК и ИВЛ) вводится атропин 3 мг однократно и адреналин 1-3 мг каждые 2-3 минуты до достижения эффекта. В оговоренных выше случаях добавляют CaCl2.
При ФЖ к реанимационным мероприятиям добавляется дефибрилляция, которая может быть фармакологической (описана выше) и электрической. При электрической дефибрилляции (ЭДФ) через миокард пропускают постоянный ток большой силы, совершающий, соответственно, большую работу[3]. Часть этой работы идет, к сожалению, на нагревание миокарда. Ток большой силы, проходя через миокард, приводит потенциалы мембран всех клеток к одному значению, после чего мы рассчитываем на синхронную электрическую активность всех клеток. Чтобы получить ток большой силы, необходимо приложить большое электрическое напряжение (разность электрических потенциалов), порядка 2-6 кВ (киловольт).
ЭДФ дозируется в единицах работы (джоулях — Дж).
Работа, в том числе и электрического тока, как известно, может быть выражена через мощность (то есть скорость выполнения работы или изменения энергии — Дж/с=Вт) и время, в течение которого она выполняется:  , где A — работа, P — мощность, t — время. Мощность электрического тока
, где A — работа, P — мощность, t — время. Мощность электрического тока  , а работа
, а работа 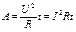 . Соотношение между U и I известно из закона Ома:
. Соотношение между U и I известно из закона Ома:  . Таким образом, работа электрического тока при ЭДФ зависит от напряжения, прикладываемого к определенным точкам грудной клетки, и от времени, в течение которого оно прикладывается, а также от электрического сопротивления тканей, через которые ток проходит. Напряжение обычно составляет несколько кВ, а время его прикладывания — 0, 02-0, 05 с.
. Таким образом, работа электрического тока при ЭДФ зависит от напряжения, прикладываемого к определенным точкам грудной клетки, и от времени, в течение которого оно прикладывается, а также от электрического сопротивления тканей, через которые ток проходит. Напряжение обычно составляет несколько кВ, а время его прикладывания — 0, 02-0, 05 с.
Начальная доза ЭДФ составляет 200 Дж. От меньших доз отказались, так как вероятность их эффективности ниже, а нагревание миокарда все равно происходит. При неэффективности дозы 200 Дж ее повышают до 300 Дж, а при неудаче — до 360-400 Дж. Затем, если нужны повторные ЭДФ, дозу не повышают.
ЭДФ осуществляют с помощью электрических аппаратов, накапливающих электрическую энергию в конденсаторах и отдающих ее в короткое время. Современные модели дефибрилляторов совмещены с кардиомонитором, причем электроды для ЭДФ являются одновременно и электродами кардиомонитора, так что сразу можно видеть результат ЭДФ. Количество сеансов ЭДФ во время СЛМР нигде не регламентируется.
Техника ЭДФ. Дефибриллятор переводится в режим зарядки до выбранной дозы. По завершении зарядки дефибриллятор подает соответствующий сигнал. После этого на грудной клетке располагаются электроды: один — во II межреберье справа по среднеключичной линии (если один из электродов плоский, то он подкладывается под левую лопатку), другой — в области верхушки сердца. Затем следует команда медперсоналу отойти от койки (во избежание электротравмы) и цепь замыкается с помощью кнопки на рукоятке электрода. Электрод должен быть смазан специальной электродной пастой или обернут марлей, смоченной физиологическим раствором. Эта мера значительно снижает переходное электрическое сопротивление между электродом и кожей, поэтому мощность  , которая выделится на этом сопротивлении, будет мала, и, следовательно, ожог в месте контакта не возникнет.
, которая выделится на этом сопротивлении, будет мала, и, следовательно, ожог в месте контакта не возникнет.