
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретичний вступ
|
|
ЛАБОРАТОРНА РОБОТА №1.
Тема. Дослідження випадкових явищ
Мета: Глибше зрозуміти поняття ентропії, інформації та термодинамічної ймовірності, перевірити закон збереження інформації.
Теоретичний вступ
Оборотні процеси можуть проходити в обох напрямках, тоді як необоротні – тільки в одному. I закон термодинаміки вимагає, щоб загальна енергія не змінилась, тоді як про напрям процесу він нічого не говорить. Напрям процесів встановлює II закон термодинаміки.
Деякі формулювання:
1) Теплота не може самовільно передаватись від менш нагрітого тіла до більш нагрітого, якщо при цьому не відбувається ніяких змін у них або в навколишньому середовищі.
2) Неможливий вічний двигун II роду, який одержував би теплоту від нагрівача і перетворював би її повністю в роботу.
Найбільш загальне формулювання II закону термодинаміки можна зробити на основі поняття ентропії.
Якщо замкнута система переходить із стану 1 у стан 2, то кількість теплоти Q, яку вона одержує з навколишнього середовища, залежить від шляху. Але, виявляється, що при цьому величина
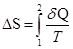 (1.1)
(1.1)
не залежить від шляху переходу з одного стану в інший, а тільки від початкового й кінцевого станів, тобто є функцією стану. Тут Т ─ абсолютна температура, 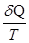 ─ приведена теплота. Величина S називається ентропією. Одиниця вимірювання ентропії [S]=Дж/К. Елементарна кількість теплоти, яку одержує система в оборотному процесі:
─ приведена теплота. Величина S називається ентропією. Одиниця вимірювання ентропії [S]=Дж/К. Елементарна кількість теплоти, яку одержує система в оборотному процесі:
δ Q=TdS
В оборотних процесах при передачі теплоти Q системі її ентропія зростає на величину (1.1), а ентропія навколишнього середовища – зменшується на таку ж величину, тобто загальна ентропія ізольованої системи не міняється.
При необоротних процесах загальна ентропія ізольованої системи завжди зростає, тобто знак зміни ентропії однозначно визначає напрям необоротного процесу. Ентропія системи змінюється не тільки за рахунок обміну теплотою з навколишнім середовищем, але й за рахунок незворотних процесів всередині самої системи. Тому елементарна кількість теплоти, яку одержує система від навколишнього середовища:
δ Q< TdS (1.2)
Загальна ентропія зростає, поки система не досягне термодинамічної рівноваги. Отже, нерівноважна система завжди прагне до максимуму ентропії.
Формулювання II закону термодинаміки: В ізольованій системі ентропія зберігає постійне значення для оборотних процесів, зростає при необоротних процесах і досягає максимуму у стані термодинамічної рівноваги.
Поняття ентропії насправді значно ширше, ніж показане в (1.1), оскільки ентропія ізольованої системи може мінятись і без передачі теплоти. Якщо ізольована система перебуває у нерівноважному стані, то перехід у стан термодинамічної рівноваги – необоротний процес, і супроводжується зростанням ентропії.
Кількість способів, якими можна зреалізувати даний стан, називається термодинамічною ймовірністю. Якщо говорити про макромолекули, то вона пропорційна математичній імовірності випадкового розміщення атомів на своїх місцях. Зрозуміло, що найбільшу математичну й термодинамічну ймовірність має стан із хаотичним, невпорядкованим розміщенням атомів. Стан із найбільшою термодинамічною ймовірністю – найбільш імовірний стан. Цей стан і є рівноважним станом. Біомакромолекула чи інша термодинамічна система, залишена сама на себе, необоротно переходить від упорядкованого стану в невпорядкований, при цьому її ентропія зростає. Ентропія є мірою безладдя.
Больцман установив зв'язок між термодинамічною ймовірністю та ентропією:
S=klnW(1.3)
k=1, 36·10–23 Дж/К – стала Больцмана.
Ізольована система завжди прагне до стану рівноваги, тобто стану з максимальною ентропією. Але навіть стану рівноваги притаманні флуктуаці ї – невеликі відхилення параметрів від рівноважних значень.
Система з безладно перемішаних молекул має максимальну ентропію, а організм з упорядкованим розміщенням молекул – набагато меншу, причому у процесі росту його ентропія зменшується. Це стає можливим унаслідок того, що організм – не ізольована, а відкрита система. Ентропія організму зменшується за рахунок зростання ентропії навколишнього середовища, а в кінцевому підсумку – Сонця: його енергія, сконцентрована в межах небесного тіла, безперервно розсіюється в просторі.
Упорядковане розміщення молекул в організмі – це наявність певної інформації I (у розумінні впорядкованості), тоді як безладдя – її повна відсутність. Тому ентропію можна розглядати як величину, протилежну до інформації, тобто як міру недостачі інформації про систему. При будь-яких процесах має місце закон збереження:
I+S=const
Одиниця кількості інформації – біт – інформація, яка міститься в достовірному твердженні, якщо кількість можливих станів ω =2, тобто математична ймовірність події P=1/2. Взагалі:
I=–log2P=log2(ω /W) (1.4)
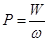
Порівнявши (1.3) і (1.4), маємо: 1 біт=0, 9427·10–23 Дж/К=0, 22·10–23 кал/К.
Розглянемо посудину, у лівій половині якої – N1 молекул, у правій половині – N2 молекул. Якщо всі молекули нерозрізнимі, то загальна кількість способів, якими реалізується стан N1 – N2:
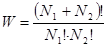
Якщо маємо, наприклад, ситему, яка складається з 6-ти однакових фазових комірок, в яких може бути поміщено деяка кількість частинок, то формула для термодинамічної ймовірності:

де A, B, C, D, E, F ─ кількість частинок в кожній з комірок.
При рівномірному розміщенні частинок по комірках маємо максимальну ентропію і відповідно мінімальну інформацію, чим нерівномірніше (більш впорядковано) розміщені частинки ─ тим менша ентропія, у випадку попадання всіх частинок в одну комірку ентропія системи буде мінімальна, а інформація ─ максимальна.
Прилади і матеріали:
1. Гральні кості.
2. Калькулятор