
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Катализаторы каталитического крекинга
|
|
Современные катализаторы каталитического крекинга – это цеолитсодержащие алюмосиликаты, состоящие на 10–25 % из цеолита типа Y в редкоземельной или декатионированной форме, равномерно распределенные в аморфном алюмосиликате в виде микросферической или шариковой форме.
Природные цеолиты представляют собой кристаллические алюмосиликаты с общей формулой Me2/nO  Al2O3
Al2O3  xSiO2
xSiO2  kH2O, где Ме – преимущественно Na, Ca, K, Ba и др.; х – силикатный модуль. Для цеолита типа А он равен 1, 8 – 2, 3, типа Х 2, 3 – 3, 0, типа Y 3, 0 – 6, 0.
kH2O, где Ме – преимущественно Na, Ca, K, Ba и др.; х – силикатный модуль. Для цеолита типа А он равен 1, 8 – 2, 3, типа Х 2, 3 – 3, 0, типа Y 3, 0 – 6, 0.
Промышленные цеолиты отличаются от природных тем, что при подготовке из них удаляют воду и заменяют путем ионного обмена катионы металлов на катионы водорода или аммония NH4 +. Такие катализаторы обладают активностью на 2 – 3 порядка выше, чем природные цеолиты.
Структура цеолита образована тетраэдрами SiO 2 и AlO 4-. Одиночный отрицательный заряд алюминат-иона компенсируется находящимися в пустотах кристаллической решетки цеолита катионами металла. Цеолиты с одновалентными катионами металлов (Na +, K +, Li + и др.) неактивны. Замена Ме + на Ме 2+ или Ме 3+ приводит к декомпенсации зарядов и создает высокую напряженность электростатического поля, достаточную для образования карб-катионов в результате смещения электронной пары:

 С – Н С+ – Н- или С = С С – – С+.
С – Н С+ – Н- или С = С С – – С+.
Аморфный алюмосиликат, в котором распределен цеолит, обладает собственной активностью. Каталитически активными центрами алюмосиликатов являются кислоты Бренстеда или Льюиса.
В качестве кислоты Бренстеда может быть протон, образующийся из воды и хемосорбированный ненасыщенным атомом алюминия (а), протон гидроксильной группы, связанный с атомом алюминия (б) или кремния (в):
 |  |  |  |

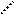




 O O O O H+
O O O O H+  – О – Si – Al: O – Si – O –Al-: H+
– О – Si – Al: O – Si – O –Al-: H+



 H
H


 O O O O
O O O O

а) б)
 |
О

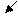

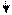


 -
-
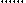

 – О – Аl – O – Si – O H
– О – Аl – O – Si – O H  +
+
– O O –
в)
Апротонным кислотным центром может быть также структура:
 | |||
 | |||
O O
 |  |
– O – Si – Al – O –.
 |
O

Переход протонной кислотности в апротонную описывается схемой:
 | |||||||
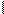 | |||||||
 |  | ||||||
O O
 |  |
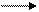
 – O – Al- – O – H H+ H2O + – O – Al (9.28)
– O – Al- – O – H H+ H2O + – O – Al (9.28)
 | |||
 | |||
 O O.
O O.
 | |||
 | |||
Наибольшее значение имеют протонодонорные центры, т. к. дегидратированный алюмосиликат неактивен. В цеолитсодержащих алюмосиликатных катализаторах роль катиона металла состоит в увеличении подвижности протона и стабильности кислотных центров Бренстеда, а также созданием дополнительного количества кислотных центров протонизацией воды:



 Ме п + + Н2О Ме п + ОН- Н+ (9.29)
Ме п + + Н2О Ме п + ОН- Н+ (9.29)
Именно поэтому скорость реакции на таком катализаторе на 2–3 порядка выше, чем на аморфном катализаторе. Цеолиты обладают также очень высокой термической и механической стабильностью.