
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Бутлеров, Александр Михайлович
|
|
Содержание
[убрать]
· 1 Предпосылки создания теории химического строения
· 2 Теория химического строения Бутлерова
· 3 Геометрия молекул
· 4 Электронные интерпретации строения молекул
· 5 Квантовая природа межатомных сил
· 6 Распределение электронной плотности в химических соединениях
· 7 Приближённые квантовохимические методы расчёта
· 8 Кампания идеологического вмешательства в теорию химического строения
· 9 Атомы в молекулах
· 10 Электронная корреляция и конфигурация молекул
· 11 Строение соединений благородных газов
· 12 Строение электронодефицитных соединений
· 13 Примечания
Предпосылки создания теории химического строения[править | править вики-текст]
Основная статья: Атомно-молекулярное учение
В 1811 году итальянский физик и химик Амедео Авогадро, изучая молекулярные веса газов (водорода, кислорода, азота, хлора), выдвинул молекулярную гипотезу строения вещества. Однако работа Авогадро долгое время не получала признания, что тормозило развитие основных идей в области химического строения молекул. Лишь после убедительного доклада Станислао Канниццаро на первым международном съезде химиков в Карлсруэ (1860) атомные веса, определённые с помощью закона Авогадро, стали общепринятыми[2]. На съезде разграничили понятия " атом", " молекула", утвердили атомно-молекулярное учение, основное положение которого " атомы при взаимодействии образуют молекулу".
Атомно-молекулярное учение послужило основой создания теории химического строения Бутлерова.
Теория химического строения Бутлерова[править | править вики-текст]
Термин «химическое строение» впервые ввёл А. М. Бутлеров 19 сентября 1861 года в докладе «О химическом строении веществ» на химической секции Съезда немецких естествоиспытателей и врачей в Шпейере (опубликованном в том же году на немецком[3] и в следующем — на русском языках[4]). В том же докладе он заложил основы классической теории химического строения. Главные положения этой теории следующие:
1. Атомы в молекулах соединены друг с другом согласно их валентности, порядок распределения связей в молекуле называется химическим строением.
2. Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
3. Свойства веществ зависят не только от их состава, но и от «химического строения», то есть от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой.
4. Атомы в молекулах оказывают влияние друг на друга и это влияние приводит к химическим изменениям поведения атома.
5. Определить состав и строение химического вещества можно по продуктам химических превращений.
Геометрия молекул[править | править вики-текст]
Основная статья: Изомерия
Основная статья: Структурная химия
В 1864 году Бутлеров первым объясняет явление изомерии, показав что изомеры – это соединения, обладающие одинаковым элементным составом, но различным химическим строением. В 1874 году возникает стереохимия, или трёхмерная структурная химия в форме постулата Вант-Гоффа о тетраэдрической системе валентностей у атома углерода.
В настоящее время принято различать структурную и пространственную изомерию.
Структурную изомерию подразделяют на изомерию скелета, обусловленную различным порядком связи атомов, образующих скелет молекулы, например в Н-бутане и изобутане, и на изомерию положения одинаковых функциональных групп при одинаковом углеродном скелете молекулы, например в орто-, мета- и пара- изомерах ароматических соединений.
Пространственная изомерия обусловлена существованием стереоизомеров, соединений, имеющих одинаковый порядок связей атомов, но различное пространственное расположение. К видам пространственной изомерии относятся: оптическая изомерия, обусловливающая существование энантиомеров – пары стереоизомеров, представляющих собой зеркальные отражения друг от друга, не совмещаемые в пространстве; диастереомерия, обусловливающая существование изомеров, не являющихся энантиомерами; геометрическая изомерия, обусловливающая цис- и транс- изомеров, свойственных соединениям с двойными связями и малыми циклами.
Электронные интерпретации строения молекул[править | править вики-текст]
Основная статья: Электронная теория химической связи
Строение молекулы H2 по Бору
С открытием в 1897 году электрона (Дж.Томсоном, Э.Вихертом) появились электронные интерпретации строения молекул. Американский физикохимикГ.Льюис в 1912 году предложил электронную теорию химической связи, по которой связь между атомами в молекуле осуществляется обобществлённойэлектронной парой. Электронная теория химической связи Льюиса стала основой классической теории строения в органической химии, базирующейся на представлении о парной связи между атомами, образованной дублетом электронов. Валентный штрих между символами элементов в молекуле был заменён двумя точками, обозначающими связывающую электронную пару.
В 1913 году датский физик Нильс Бор предложил рассматривать электронную пару в форме вращающегося кольца, плоскость которого перпендикулярна оси молекулы и равноудалена от ядер атомов (см.рис.).
Динамическое равновесие молекулярной системы, по Бору, достигается за счёт баланса сил между силами взаимного отталкивания ядер и силами притяжения ядер к плоскости кольца электронов. Боровская интерпретация строения молекулы учитывала кулоновскую электронную корреляцию - электроны в кольце находятся в диаметрально противоположном положении.
Молекулу метана Нильс Бор описывал следующим образом:
" Ядро углерода, заключённое в очень маленькое кольцо из двух электронов, расположено в центре (тетраэдра), а ядро водорода по углам. Химические связи представляют собой четыре двухэлектронных кольца, вращающихся вокруг линий, соединяющих центр с углами". [5]
Квантовая природа межатомных сил[править | править вики-текст]
Основная статья: Дисперсионные силы
Схема диполь-дипольного взаимодействия 2-х атомов водорода по Лондону
В своём докладе, прочитанном в Королевском колледже в Лондоне в ознаменовании столетия опубликования трудов Клерка Максвелла по электромагнитному излучению, К.Коулсон даёт анализ происхождения и сущности межатомных сил, приводящих к образованию молекулы [6]. К.Коулсон, ссылаясь на работуЛондона, на примере двух атомов водорода показывает " каким образом два нейтральных атома или молекулы могут оказывать притяжение друг к другу на значительном расстоянии".
Ядра A и B двух атомов водорода находятся на расстоянии r друг от друга (рис.). Каждый атом несёт по одном электрону (в P и Q соответственно). Совокупность зарядов +e в A и -e в P приблизительно эквивалентна электрическому диполю, имеющему величину e·AP. Подобным же образом совокупность +e в B и -e в Q приблизительно эквивалентна электрическому диполю e·BQ. Эти два диполя взаимодействуют друг с другом. Общая потенциальная энергия двух диполей, m и m', находящихся на расстоянии r, равна:
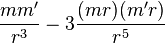 [6]
[6]
На языке волновой механики это выражение рассматривается как возмущение, действующее на оба атома.
Природа межатомных сил имеет электромагнитный характер и называется диполь-дипольным взаимодействием. Существуют, конечно диполь-квадрупольные, квадруполь-квадрупольные и другие взаимодействия, при которых энергия изменяется в зависимости от более высоких степеней 1/r.[6]
Распределение электронной плотности в химических соединениях[править | править вики-текст]
Основная статья: Электронная плотность
Основная статья: Статистическая интерпретация волновой функции

Рис.Радиальное распределение вероятности нахождения электрона в атоме водорода.
Рис.Модель молекулы водорода и её осевая проекция
Электронная плотность - это плотность вероятности обнаружения электрона в даной точке пространства. Электронная плотность нормирована и, соответственно, указывает на вероятное число электронов в данном элементарном объёме.
Вероятностную (статистическую) интерпретацию волновой функции сформулировал М.Борн в 1926 году как только было опубликована волновое уравнение Шрёдингера. В 1954 году М.Борн удостоен Нобелевской премии по физике с формулировкой " За фундаментальное исследование в области квантовой механики, особенно за статистическую интерпретацию волновой функции".
Расчёт электронной плотности проводят с использованием уравнения Шрёдингера, которое решается аналитически точно для систем, содержащих только один электрон.[7]
Получаемая радиальная функция распределения вероятности нахождения электрона в атоме водорода обладает максимумом при α 0, как показано на рисунке. Этот наиболее вероятный радиус совпадает с боровским радиусом и принят в качестве атомной единицы для линейных размеров 1 а.е. (бор) = 0, 529177 · 10-10м ≈ 0, 529 Å. Более размытое облако плотности вероятности, полученное при решении уравнения Шрёдингера для атома водорода, значительно отличается отборовской модели атома и согласуется с принципами неопределённости Гейзенберга. С учётом статистической интерпретации волновой функции М.Борна и принципа неопределённости Гейзенберга длины диполей AP и BQ взаимодействующих атомов в расчётах Ф.Лондона достаточно размыты. Размыто и электронное кольцо в модели молекулы водорода по Н.Бору до состояния тороидального электронного облака с неопределёнными границами.
Наиболее вероятный радиус электронного кольца (тора) молекулы водорода (re) определяется боровским радиусом (α 0) и длиной химической связи (d): re2 = α 02 - (d/2)2; re = 0, 374 Å.
Благодаря пространственной симметрии дипольный момент молекулы водорода равен нулю, что соответствует её низкой химической активности[8]. Пространственная симметрия электронной плотности сохраняется, если соединяющиеся в молекулу атомы имеют одинаковую энергию ионизации. В этом случае связывающее электронное кольцо располагается на равном расстоянии от каждого из ядер. Если же потенциалы ионизации различны электронная плотность смещается в сторону атома с большим первым потенциалом ионизации[9]. Смещение электронной плотности приводит к асимметрии распределения электрических зарядов в молекуле, молекула становится полярной системой с определённым дипольным моментом.
Приближённые квантовохимические методы расчёта[править | править вики-текст]
Основная статья: квантовая химия
Поскольку точное решение уравнения Шрёдингера для атомно-молекулярных систем, содержащих два и более электрона, невозможно, предложены приближённые методы расчёта электронной плотности. Все они возникли в тридцатых годах прошлого века, проделали значительный путь развития и долгое время дополняли друг друга. Наиболее важные из них - теория валентных связей, теория молекулярных орбиталей, теория кристаллического поля, теория функционала плотности.
В рамках теории валентных связей разработана концепция резонанса (Л. Полинг) и родственная ей концепция мезомерии (К. Ингольд). Концепция резонанса рассмотрена на примеремолекулярного иона водорода. Л. Полинг показал, что стабильность молекулярного иона водорода " вызвана резонансом электрона, т.е. движением его " взад и вперёд" между двумя ядрами с " резонансной частотой", равной по величине энергии резонанса (50 ккал/моль), делённой на константу Планка h. Для молекулярного иона в основном состоянии эта частота равна 7.1014сек-1".[10]Концепция резонанса дополняла постулаты классической теории химического строения и утверждала, что если для данного соединения классическая теория допускает построение нескольких приемлемых структурных формул, то действительному состоянию молекул этого соединения отвечает не какая-либо одна отдельная формула, а некоторое их сочетание (наложение, резонанс структур).[11] Мезомерия является теорией электронного строения химических соединений, согласно которой истинное распределение электронной плотности в молекуле является промежуточным между распределениями, представленными несколькими классическими формулами.[12] Обычно рассматривают положительный и отрицательный мезомерные эффекты:
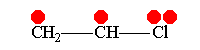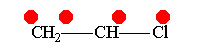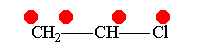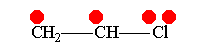
Винилхлорид+М-эффект
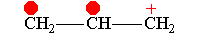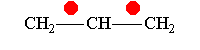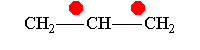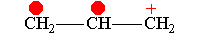
Аллил-катион-М-эффект
Кампания идеологического вмешательства в теорию химического строения[править | править вики-текст]
Основная статья: идеологический контроль в советской науке
Кампания началась в 1949 году с публикации статьи В. М. Татевского и М. М. Шахпаронова " Об одной махистской теории в химии и её пропагандистах " (журнал " Вопросы философии, 1949, № 3, стр. 176—192). В качестве главного объекта нападения была выбрана теория резонанса Л. Полинга. Было объявлено, что " представления о реальной молекуле как о чём-то среднем между двумя (и более) крайними абстрактными структурами являются буржуазными и поэтому направленными против всего самого «святого». Были указаны и пропагандисты теории Я. К. Сыркин и М. Е. Дяткина — авторы книги «Химическая связь и строение молекул», в которой нашла отражение теория резонанса. «В воздухе очередной раз запахло инквизицией. В этой тревожной обстановке ведущие химики страны собрались на Всесоюзное совещание по проблемам химического строения (1951 г., Москва). Стенограмма этого совещания — один из наиболее позорных документов, когда-либо созданных коллективными усилиями ученых, хранится в химических библиотеках всего мира, и от этого срама бог весть когда ещё удастся отмыться… До крови не дошло — спасла оттепель, начавшаяся весной следующего года. Я. К. Сыркин и М. Е. Дяткина, подготовленные недавними друзьями и коллегами к выдаче в качестве первых козлов отпущения, уцелели; более того Я. К. Сыркин в дальнейшем стал академиком».[13] Лайнус Полинг удостоен в 1954 году Нобелевской премии по химии с формулировкой «За исследование природы химической связи и её применение для определения структуры сложных соединений». Но консенсус в теории химического строения не был достигут. В. М. Татевский в курсе «Строение молекул» (1977 г.) отмечал: «… полностью выпадают и „висят в воздухе“ представления уходящих в прошлое, но всё ещё фигурирующих в литературе так называемых „теории резонанса“ и „теории мезомерии“, которые не имеют основы ни в классической теории химического строения, ни в законных приложениях классической физики к вопросам строения молекул, ни в квантовой механике».[14] Лишь в 1991 году проведён принципиальный анализ кампании по борьбе с теорией резонанса. Показано, что эта кампания «нанесла серьёзный ущерб престижу советской науки».[15]
Атомы в молекулах[править | править вики-текст]
В классической теории химического строения понятие атома в молекуле является изначальным. Интуитивно ясно, что атом в молекуле меняется, меняются и его свойства в зависимости от окружения этого атома, прежде всего ближайшего. Основным показателем является расстояние между атомами в молекуле, определяющее как длину химической связи, так и прочность химической связи.
В квантовой теории понятие атома вторично. Так, по утверждению Татевского В.М., молекула не состоит из атомов: " С современной точки зрения ясно, что при образовании молекулы сохраняются не атомы, а только ядра атомов и электроны". [16]
Было предпринято множество попыток сохранить понятие атома в молекуле, но, тем не менее, практически всегда они не удовлетворяли последующих исследователей по тем или иным причинам.
Одна из наиболее удачных попыток сохранения классической концепции атома в молекуле принадлежит Р. Бейдеру и его сотрудникам [17]
В рамках этой теории (QTAIM) электронная плотность " задаёт некоторое скалярное поле в трёхмерном пространстве, которое может быть охарактеризовано, например, его совокупностью экстремальных точек, линий и поверхностей, особых точек и т.п." [18]
Таким образом, в квантовой теории атомов в молекулах Р.Бейдера оказывается возможным физическое обоснование ключевых понятий химии " Атом", " Молекула", " Химическая связь" в терминах топологии функции электронной плотности в трёхмерном пространстве и описание химического строения молекул.
Электронная корреляция и конфигурация молекул[править | править вики-текст]
Основная статья: Теория отталкивания электронных пар
Электронная корреляция (взаимная обусловленность движения всех электронов атомной или молекулярной системы как целого определяется электростатическим отталкиванием электронов (кулоновская электронная корреляция) и статическим особенностями систем, в частности принципом Паули (фермиевская корреляция). Полный учёт электронной корреляции при расчёте энергии и определении электронной структуры системы достигается методом конфигурационного взаимодействия.
Простая и надёжная система правил для понимания и предсказания конфигурации молекул заложена в теории отталкивания электронных пар, наиболее важное правило которой достаточно эмпирично, хотя имеет квантовомеханическое обоснование, заключающееся в принципе Паули, а именно " электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга". При этом конфигурация молекулы будет определяться числом связывающих и неподелённых электронных пар у центрального атома: две связывающие электронные пары дают линейную конфигурацию молекулы, три - конфигурацию правильного треугольника, четыре - конфигурацию тетраэдра, пять - тригонально-бипирамидальную конфигурацию, шесть - конфигурацию октаэдра.
Наличие неподелённых электронных пар у центрального атома приводит к расширению типов конфигураций молекулы. [19]
Строение соединений благородных газов[править | править вики-текст]

Молекула дифторида ксенона

Молекула тетрафторида ксенона

Молекула гексафторида ксенона
Открытие Бартлеттом в 1962 году первого соединения ксенона положило начало интенсивному развитию химии благородных газов, что привело к получению большого ряда соединений инертных газов и установлению их химического строения.
Оказалось, что все соединения благородных газов имеют обыкновенные ковалентные связи и общепринятые конфигурации молекул. Так, конфигурация молекулыдифторида ксенона линейна − связи ксенон-фтор являются аксиальными и взаимодействуют с тремя неподелёнными электронными парами, находящимися в экваториальных положениях.
В молекуле тетрафторида ксенона осуществляется конфигурация с плоским квадратным расположением лигандов. Неподелённые электронные пары ксенона максимально удалены друг от друга и расположены по разные стороны от этого квадрата.
Структура молекулы гексафторида ксенона представляет собой искажённый октаэдр. " Отклонение атомов фтора от вершин правильного октаэдра указывает на то, что неподелённая электронная пара занимает положение над центром одной из граней октаэдра, а атомы фтора, расположенные в углах этой грани, вынуждены раздвинуться".[19]
Открытие Бартлетта показало ошибочность популярного в то время правила октета, согласно которому при образовании молекул атомы удовлетворяют свою потребность в достижении 8-электронной валентной оболочки, подобной электронной конфигурации благородных газов за счёт попарного обобществления своих валентных электронов. Оказалось, что атомы благородных газов, имея полностью заполненную валентную оболочку, могут вступать в химические ракции и участвовать в химическом строении молекул.
Строение электронодефицитных соединений[править | править вики-текст]
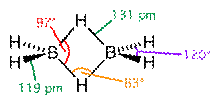
Диборан
Структурная проблема, связанная с электронодефицитными соединениями, довольно сложна. Фундаментальная трудность заключалась в том, что в молекулах нет достаточного числа валентных электронов для того, чтобы связать все атомы обычными двухэлектронными связями. Так, например, в молекуле диборана имеется двенадцать валентных электронов, все двенадцать нужны для образования ковалентных связей шести атомов водорода с бором, так что для связи атомов бора между собой электронов не остаётся. Сам Полинг допускал, что в диборане функционируют одноэлектронные связи, а молекула в основном состоянии резонирует между семью структурами льюисовского типа, а также между многочисленными структурами, содержащими одноэлектронные связи.
Однако заслуженное признание получили исследования природы химической связи в бороводородах, выполненные американским физикохимиком Липскомбом. По интерпретации Липскомба в диборане имеют место четыре двух- и две трёхцентровые связи.
Четыре концевые двухцентровые двухэлектронные связи HB лежат в одной плоскости. Два же центральных атома водорода расположены симметрично над этой плоскостью и под нею и объединены с атомами бора двумя трёхцентровыми связями.
В 1976 году Липскомб удостоен Нобелевской премии по химии с формулировкой " За исследование структуры боранов (боргидритов), проясняющих проблему химических связей".
Бутлеров, Александр Михайлович
[править | править вики-текст]
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 1 октября 2013; проверки требуют 58 правок.
Запрос «Бутлеров» перенаправляется сюда; см. также другие значения.
| Александр Михайлович Бутлеров | |
| |
| Дата рождения: | 3 (15) сентября 1828 |
| Место рождения: | Чистополь, Казанская губерния, Российская империя |
| Дата смерти: | 5 (17) августа 1886 (57 лет) |
| Место смерти: | Бутлеровка, Казанская губерния, Российская империя |
| Страна: |  Российская империя Российская империя
|
| Научная сфера: | химия |
| Альма-матер: | Казанский университет |
| Известные ученики: | В. В. Марковников, А. Н. Попов, А. М. Зайцев, А. Е. Фаворский, М. Д. Львов, И. Л. Кондаков, Е. Е. Вагнер, Д. П. Коновалов, Ф. М. Флавицкий, А. А. Кракау, П. П. Рубцов |
| Известен как: | создатель теории химического строения органических веществ, родоначальник «бутлеровской школы» |
| Александр Михайлович Бутлеров наВикискладе |
Алекса́ ндр Миха́ йлович Бу́ тлеров (3 сентября [15 сентября] 1828[1], Чистополь — 5 августа [17 августа] 1886, деревня Бутлеровка, ныне Алексеевский район Татарстана) — русский химик, создатель теории химического строения органических веществ, родоначальник «бутлеровской школы»[2] русских химиков, учёный-пчеловод и лепидоптеролог, общественный деятель, ректор Императорского Казанского университета в 1860—1863 годах.
Содержание
[убрать]
· 1 Биография
· 2 Адреса в Санкт-Петербурге
o 2.1 Создание теории химического строения
o 2.2 Современное значение теории химического строения им. Бутлерова
· 3 Педагогическая деятельность
· 4 Общественная деятельность
· 5 Интересные факты
· 6 Память
· 7 Сочинения
· 8 Комментарии
· 9 Примечания
· 10 Литература
· 11 Ссылки
Биография[править | править вики-текст]
Родился в семье помещика, офицера в отставке — участника Отечественной войны 1812 года, в Чистополе Казанской губернии. Детство его протекало сначала в деревне Бутлеровке — имении отца, затем в Казани.
Первоначальное образование получил в частном пансионе Топорнина — учителя французского языка 1-й Казанской гимназии, а затем в 1-й казанской гимназии[Комм 1], в 1844—1849 годах студент Казанского университета «разряда естественных наук». Получая широкую подготовку в области естествознания, он в первые годы проявил большой интерес к ботанике и зоологии. В 1849 году пишет дипломную работу «Дневные бабочки волго-уральской фауны». Эта особенность полученного образования, по-видимому, была одной из причин того, что, уже став химиком с мировым именем, А. М. Бутлеров по-прежнему сохранял интерес к живой природе и, в частности, был одним из организаторов и постоянных сотрудников журнала «Пчеловодный листок». По окончанию университета Бутлеров продолжил свою учёбу в роли «оставленного при университете для подготовки к профессорскому званию». В 1854 он сдал экзамен и защитил диссертацию на степень доктора химии. В последующие годы А. М. Бутлеров много размышляет над теоретической стороной химии и уже в 1858 г., во время первой поездки за границу, высказывает на заседании Парижского химического общества свои теоретические взгляды, которые через три года, в 1861 г., в более развитом виде становятся предметом его известного доклада «О химическом строении вещества». С 1849 преподаватель, с 1854 экстраординарный, а с 1857 ординарный профессор химии в том же университете. В 1860—1863 был дважды его ректором.
В 1868 стал лауреатом Ломоносовской премии и был избран профессором химии Петербургского университета. В своем представлении Д. И. Менделеев писал:

| А.М.Бутлеров - один из замечательнейших русских учёных. Он русский и по учебному образованию, и по оригинальности трудов. Ученик знаменитого академика нашего Н.Н.Зинина, он сделался химиком не в чужих краях, а в Казани, где и продолжает развивать самостоятельную химическую школу. Направление научных трудов Александра Михайловича не составляет продолжения или развития идей его предшественников, но принадлежит ему самому. В химии существует бутлеровская школа, бутлеровское направление. | 
|
В Петербурге А.М.Бутлеров развернул работы по непредельным соединениям, начатые ещё в Казани, а также продолжил теоретические работы. В 1885 вышел в отставку, но продолжал читать в университете специальные курсы лекций. В 1870 был избран адъюнктом, в 1871 — экстраординарным, а в 1874 — ординарным академиком Петербургской АН. В 1878—1882 преемник Н. Н. Зинина на посту председателя Отделения химии Русского химического общества. Почётный член многих других научных обществ в России и за рубежом. 14 мая 1885 г., заканчивая свою последнюю лекцию, А.М.Бутлеров с гордостью говорил о росте русской химической науки и предсказывал ей блестящее будущее. 17 августа 1886 г. А.М. Бутлеров умер в деревне Бутлеровке Казанской губернии. Созданные при его участии крупнейшие русские химические школы - Казанская, Петербургская, Московская (обязанная своим расцветом В.В. Марковникову) - продолжил развитие органической химии, внося достойный вклад не только в отечественную, но и в мировую науку.
Адреса в Санкт-Петербурге[править | править вики-текст]
1870 — 05.08.1886 года — 8-я линия, 17, кв. 2.еятельность
Ещё будучи воспитанником пансиона начал интересоваться химией: вместе с коллегами пытались изготовить то порох, то «бенгальские огни». Однажды, когда один из опытов привел к сильному взрыву, воспитатель сурово наказал его. Три дня подряд Сашу выводили и ставили в угол на всё время пока другие обедали. На шею ему вешали чёрную доску, на которой было написано «Великий химик». Впоследствии эти слова стали пророческими. В Казанском университете Бутлеров увлёкся преподаванием химии, профессорами которой были К. К. Клаус и Н. Н. Зинин. С 1852 года, после перехода Клауса в Дерптский университет, Бутлеров возглавил преподавание всей химии в Казанском университете. В 1851 Бутлеров защитил магистерскую диссертацию «Об окислении органических соединений», а в 1854 в Московском университете — докторскую диссертацию «Об эфирных маслах». Во время заграничной поездки в 1857—1858 сблизился со многими видными химиками, в том числе с Ф. А. Кекуле и Э. Эрленмейером, и провёл около полугода в Париже, деятельно участвуя в заседаниях только что организованного Парижского химического общества. В Париже, в лабораторииШ. А. Вюрца, Бутлеров начал первый цикл экспериментальных исследований. Открыв новый способ получения йодистого метилена, Бутлеров получил и исследовал многочисленные его производные; впервые синтезировал гексаметилентетрамин (уротропин) и тример формальдегида (триоксиметилен). В работе, опубликованной в 1861 году[3] Бутлеров показал, что триоксиметилен при обработкеизвестковой водой переходит в сахаристое вещество (реакция Бутлерова), которое он назвал метиленитаном (позднее Э. Фишер установил, что метиленитан — неоднородное вещество, содержащее α -акрозу и формозу[4]). В этой статье Бутлеров отметил, что получение метиленитана — первый полный синтез сахаристого вещества.
Создание теории химического строения[править | править вики-текст]
Первое публичное выступление А.М. Бутлерова по теоретическим вопросам органической химии относится к концу 50-х годов: его доклад на заседании Парижского химического общества 17 февраля 1858 г. В нём говорится, что за радикалы следует считать не только органические группы, но и группировки типа OH, NH2, т.е. характерные для различных классов органических веществ сочетания атомов, которые впоследствии получили название функциональных групп. В этом же докладе Бутлеров впервые употребил и сам термин " структура", относя к одному типу молекулярной структуры метан, хлористый метил, хлористый метилен, хлороформ, четырёххлористый углерод, метиловый спирт. В следующем, 1859 г., А.М.Бутлеров писал:

| Экспериментальные исследования дадут нам основание для истинной химической теории, которая будет математической теорией молекулярной силы, называемой нами химическим сродством. Поскольку, однако, сродство есть не только причина превращений, но и причина определённой группировки элементарных атомов в химической молекуле, то оно и должно изучаться не только во время производимого ими движения молекул, но так же и в состоянии равновесия материи. | 
|
Таким образом, уже в 1858 г. А.М.Бутлеров вышел за пределы представлений Ш..Жерара в весьма существенном пункте: он считал возможным говорить об определённой группировке атомов в сложных частицах, причём причину этой группировки видел в химическом сродстве. В этих словах содержалась, по существу, одна из основных идей теории химического строения. В более развитой форме идея химического строения была изложена А.М.Бутлеровым три года спустя в докладе " О химическом строении вещества", с которым он выступил, прочитанном в химической секции Съезда немецких естествоиспытателей и врачей в Шпейере (19 сентября 1861) и опубликованном в том же году на немецком[5] и в следующем — на русском языках[6]. В этом докладе прежде всего говорилось, что теоретическая сторона химии не отвечает фактическому развитию, отмечалась, в частности, некомпетентность теории типов. А.М.Бутлеров при этом был далёк от огульного отрицания её; он справедливо указывал на то, что теория типов имеет и важные заслуги. Однако типические формулы указывали лишь направление возможных реакций замещения и разложения, но и не могли выразить реакций присоединения (например, образование йодистого этила из этилена и йодистого водорода). Так как вещество может разлагаться по нескольким направлениям, Ш.Жерар и его сторонники допускали возможность употребления нескольких рациональных формул для одного и того же вещества. Бутлеров полемизировал в докладе против утверждения Жерара, что

| нельзя судить о положении атомов внутри частиц... судить о механическом строении тел | 
|
. Критическое рассмотрение Бутлеров закончил словами:

| Наступает время, когда теория Жерара должна будет уступить место понятию об атомности паев | 
|
(т.е. на нашем современном языке - о валентности атомов).
Основы этой теории сформулированы таким образом:
1. «Полагая, что каждому химическому атому свойственно лишь определённое и ограниченное количество химической силы (сродства), с которой он принимает участие в образовании тела, я назвал бы химическим строением эту химическую связь, или способ взаимного соединения атомов в сложном теле»[7]
2. «… химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением»[8]
С этим постулатом прямо или косвенно связаны и все остальные положения классической теории химического строения. Бутлеров намечает путь для определения химического строения и формулирует правила, которыми можно при этом руководствоваться. Предпочтение он отдаёт синтетическим реакциям, проводимым в условиях, когда радикалы, в них участвующие, сохраняют своё химическое строение. Однако Бутлеров предвидит и возможность перегруппировок, полагая, что впоследствии «общие законы» будут выведены и для этих случаев. Оставляя открытым вопрос о предпочтительном виде формул химического строения, Бутлеров высказывался об их смысле: «… когда сделаются известными общие законы зависимости химических свойств тел от их химического строения, то подобная формула будет выражением всех этих свойств».
Далее в докладе говорится о путях, которые могут применяться для изучения химического строения. О последнем можно судить, прежде всего, на основании способов синтеза вещества, причём наиболее надёжные заключения могут быть сделаны при изучении синтезов, " которые совершаются при температуре мало возвышенной, и вообще при условиях, где можно следить за ходом постепенного усложнения химической частицы". Реакции разложения - преимущественно тоже протекающие в мягких условиях - также дают возможность сделать заключения о химическом строении, т.е. полагать, что " остатки (радикалы) находились готовыми в разложившейся частице". Вместе с тем, А.М. Бутлеров предвидел, что не все реакции пригодны для определения строения: существуют среди них такие, при которых " изменяется химическая роль нескольких паев, а значит, и строение". В переводе на наш современный язык это реакции, сопровождающиеся изомеризацией скелета или переносом реакционного центра.
Бутлеров впервые объяснил явление изомерии тем, что изомеры — это соединения, обладающие одинаковым элементарным составом, но различным химическим строением. В свою очередь, зависимость свойств изомеров и вообще органических соединений от их химического строения объясняется существованием в них передающегося вдоль связей «взаимного влияния атомов», в результате которого атомы в зависимости от их структурного окружения приобретают различное «химическое значение». Таким образом, построенная на базе химического строения рациональная формула, подчёркивал А.М.Бутлеров, будет однозначной:

| Для каждого тела возможна будет, в этом смысле, лишь одна рациональная формула, и когда сделаются известными общие законы зависимости химических свойств тел от химического строения, то подобная формула будет выражением всех этих свойств. Типические формулы в их нынешнем значении должны бы тогда выйти из употребления... Дело в том, что эти формулы тесны для настоящего состояния науки! | 
|
Самим Бутлеровым и особенно его учениками В. В. Марковниковым и А. Н. Поповым это общее положение было конкретизировано в виде многочисленных «правил». Уже в XX веке эти правила, как и вся концепция взаимного влияния атомов, получили электронную интерпретацию.
Большое значение для становления теории химического строения имело её экспериментальное подтверждение в работах как самого Бутлерова, так и его школы. Он предвидел, а затем и доказал существование позиционной и скелетной изомерии. Получив третичный бутиловый спирт, он сумел расшифровать его строение и доказал (совместно с учениками) наличие у него изомеров. В 1844 Бутлеров предсказал существование двух бутанов и трёх пентанов, а позднее и изобутилена. Чтобы провести идеи теории химического строения через всю органическую химию, Бутлеров издал в 1864—1866 в Казани 3 выпусками «Введение к полному изучению органической химии», 2-е издание которого вышло в 1867—1868 на немецком языке.
Бутлеров впервые начал на основе теории химического строения систематическое исследование полимеризации, продолженное в России его последователями и увенчавшееся открытиемС. В. Лебедевым промышленного способа получения синтетического каучука.
Современное значение теории химического строения им. Бутлерова[править | править вики-текст]
С тех пор как А.М.Бутлеров создал свою теорию химического строения органических соединений прошло больше ста пятидесяти лет. За это время наука вообще и органическая химия в частности сделали колоссальные успехи. Естественно, встаёт вопрос: каково место бутлеровской теории в современной органической химии? Ответ на этот вопрос затрудняется тем, что сам А.М.Бутлеров не сформулировал теорию химического строения пункт за пунктом: она рассеяна во многих публикациях, пронизывает всё его научное творчество. О многих сторонах теории химического строения у нас уже была речь. Постараемся теперь провести сравнение первозданной теории с её нынешним, усовершенствованным вариантом.
· Атомы в органических соединениях связаны друг с другом в определённом порядке химическими силами. Современная наука гораздо глубже проникла в природу химических сил и химической связи. Во времена Бутлерова лишь в общих словах говорили о силах валентности и условно изображали чёрточкой химическую связь между атомами. В наше время выяснено, что силы валентности имеют электронную природу: чёрточка символизирует ковалентную связь, пару электронов. Применяя законы квантовой механики, можно математически описать химическую связь в полном соответствии с тем, что предвидел А.М.Бутлеров.
· Строение можно изучать химическими методами — второе важнейшее бутлеровское положение — также не потеряло своего значения в наши дни. Изучение строения органических соединений — природных и синтетических — было и остаётся основной задачей органической химии. При этом, как и во времена А.М.Бутлерова, мы пользуемся методами химического анализа и синтеза. Однако, наряду с ними в наше время широко применяются физические методы исследования строения — разные виды спектроскопии, ядерный магнитный резонанс, масс-спектрометрия, определение дипольных моментов, рентгенография, электронография.
· Формулы должны выражать порядок химической связи атомов. Современная наука полностью принимает это положение, но в те времена различали формально лишь три типа связи — простую, двойную, тройную, то теперь мы знаем о химических связях гораздо больше: мы можем характеризовать каждую конкретную связь её физическими параметрами. Например, длиной, валентным углом, энергией, полярностью, поляризуемостью. Нередко свойства связей меняются под влиянием соседних атомов, соседних связей. В этом проявляется взаимное влияние атомов — понятие введённое в науку А.М.Бутлеровым и В. В. Марковниковым, а ныне раскрытое в конкретных формах электронных эффектов (индукционного, мезомерного) и пространственных влияний.
· Каждое вещество имеет одну определённую формулу строения. Это положение, естественно, сохранило силу. Часто спрашивают о том, как это согласуется с явлением таутомерии — способностью некоторых органических веществ существовать в виде находящихся в равновесии нескольких изомерных форм? Прекрасно иллюстрирует выполнение этого пункта при таутомерии — это моносахариды, способные существовать в альдегидной и циклической формах. Правила Бутлерова это никак не нарушает: в равновесии находятся два вещества, каждое из которых имеет определённую структурную формулу. Это изомеры, всё своеобразие которых в том, что они в обычных условиях легко переходят друг в друга.
· Формула должна отражать строение реально существующей молекулы. Это положение философски правильно, однако, всю сумму современных знаний об органическом веществе уже нельзя уложить в простейшую структурную формулу, изображающую молекулу как сочетание символов атомов и чёрточек связей. Поэтому нередко можно видеть в составе структурных формул всевозможные стрелки, пунктиры, знаки зарядов и другие символы позволяющие полнее понять строение молекулы. Всё это улучшает соответствие между формулой и реальной молекулой, т.е. отвечает принципам теории строения, а не отменяет её.
С развитием науки мы будем дополнять имеющийся материал органической химии новыми сведениями, но основные положения бутлеровской теории навсегда сохранят свою силу как часть объективной истины.
Педагогическая деятельность[править | править вики-текст]
Огромная заслуга Бутлерова — создание первой русской школы химиков. Ещё при его жизни ученики по Казанскому университету В. В. Марковников, А. Н. Попов, А. М. Зайцев заняли профессорские кафедры в университетах. Из учеников Бутлерова по Петербургскому университету наиболее известны В.Е.Тищенко, А. Е. Фаворский, М. Д. Львов и И. Л. Кондаков. В разное время в бутлеровской лаборатории работали практикантами Е. Е. Вагнер, Д. П. Коновалов, Ф. М. Флавицкий, А. И. Базаров, А. А. Кракау, А. П. Эльтеков и др. видные русские химики. Отличительной чертой Бутлерова как руководителя было то, что он учил примером — студенты всегда могли сами наблюдать, над чем и как работает профессор.
Общественная деятельность[править | править вики-текст]
Памятник Александру Бутлерову в Казани
Много сил отнимала у Бутлерова борьба за признание Академией наук заслуг русских учёных. В 1882 в связи с академическими выборами Бутлеров обратился непосредственно к общественному мнению, опубликовав в московской газете «Русь» обличительную статью «Русская или только Императорская Академия наук в Санкт-Петербурге?».
Бутлеров был поборником высшего образования для женщин, участвовал в организации Высших женских курсов в 1878, создал химические лаборатории этих курсов. В Казани и Петербурге Бутлеров прочитал много популярных лекций, главным образом на химико-технические темы.
Кроме химии, Бутлеров много внимания уделял практическим вопросам сельского хозяйства, садоводству, пчеловодству, а позднее также и разведению чая наКавказе. Был основателем и, первое время, главным редактором «Русского Пчеловодного Листка». Будучи одним из организаторов Русского общества акклиматизации животных и растений, внес большой вклад в развитие садоводства и пчеловодства. Написанная им книга «Пчела, её жизнь и главные правила толкового пчеловодства» выдержала более 10 переизданий до революции, выходила также и в советское время.
Интересные факты[править | править вики-текст]
· С конца 1860-х годов Бутлеров проявлял интерес к спиритизму.
· Известна научная шутка, когда в качестве примера расширения тел при нагревании и сжатии их при охлаждении приводят, что летом дни длинные, а зимой - короткие. Один раз Бутлеров поставил зачёт студенту за такой пример. Студентом этим был Владимир Иванович Вернадский.
Память[править | править вики-текст]

Почтовая маркаСССР, 1951 год
Память о Бутлерове была увековечена только при Советской власти; было осуществлено академическое издание его трудов.
· В 1953 году перед зданием химического факультета МГУ ему был открыт памятник.
· В 1970 году в честь А. М. Бутлерова назван кратер на Луне.
· В 1978 году издан художественный маркированный конверт, посвященный ученому.
· Химический факультет Казанского Федерального университета был преобразован в Химический институт им. А. М. Бутлерова после слияния с НИХИ им. А. М. Бутлерова в 2002 году.
· Улицы Бутлерова есть в Казани, Москве, Санкт-Петербурге, Даугавпилсе (в районе Посёлок Химиков), Киеве (в районе ПО «Химволокно» — Дарницкая промзона), Дзержинске (Нижегородская область), Чистополе (Татарстан), Волгограде.
· 18—23 сентября 2011 года в Казани прошёл Международный конгресс по органической химии, посвященный А. М. Бутлерову — «Бутлеровский конгресс»[9][10]
Сочинения[править | править вики-текст]
1. Бутлеров А. М. Дневные бабочки Волго-Уральской фауны. — Казань: тип. Имп. Казанск. ун-та, 1848. — 60 с.
2. Бутлеров А. М. Отчет об опыте перерождения овса в рожь // Записки Казанского экономического общества, 1855, часть 2, отд. 2. — С. 109—112.
3. Бутлеров А. М. Введение к полному изучению органической химии, в. 1—3, Казань, 1864—1866.
4. Бутлеров А. М. Пчела, её жизнь и главные правила толкового пчеловодства. Краткое руководство для пчеляков, преимущественно для крестьян. — СПб., 1871.
5. Бутлеров А. М. Статьи по медиумизму. — СПб., 1889.
6. Бутлеров А. М. Статьи по пчеловодству. — СПб., 1891.
7. Бутлеров А. М. Избранные работы по органической химии. — М., 1951 (библ. трудов по химии).
8. Бутлеров А. М. Сочинения: В 3 т. — М., 1953—1958 (библ. трудов).
9. Бутлеров А. М. Научная и педагогическая деятельность: Сборник документов. — М., 1961.
Комментарии[править | править вики-текст]
1. ↑ В 1842 году пансион Топорнина, находившийся на Грузинской улице (теперь К. Маркса), настолько пострадал от пожара, что его пришлось закрыть и отец Бутлерова решил определить сына в 1-ю Казанскую гимназию своекоштным учеником — в 6-й, предпоследний, класс. Однако в архиве гимназии нет копии аттестата Бутлерова при наличии аттестатов или свидетельств об окончании гимназии всех его соучеников; по-видимому Бутлеров юридически гимназии не окончил, фактически получив в ней среднее образование. Поэтому директор гимназии Н. А. Галкин в письме на имя ректора университета Н. И. Лобачевского, куда поступал Бутлеров просил: «…допустить к экзамену вместе с учениками 1 и 2-й Казанской Гимназии, для поступления в студенты, родственника моего, сына подполковника Бутлерова, Александра Бутлерова». — см. Гречкин Н. П. Александр Михайлович Бутлеров (его жизнь и деятельность в Казани).
Примечания[править | править вики-текст]
1. ↑ Гумилевский, 1951
2. ↑ Определение Д. И. Менделеева; Зинин — Бутлеров — Марковников — Каблуков — Фаворский — Зелинский — Несмеянов — ученики Несмянова — остальные.
3. ↑ Boutlerow A. (1861). «Faits pour servir à l'histoire des dé rivé s mé thylé niques». Bulletin de la Socié té chimique de Paris: 84-90. Русский перевод: К истории производных метилена // А.М.Бутлеров. Сочинения. — М.: Издательство Академии наук СССР, 1953. — Т. 1. — С. 63—67.
4. ↑ Орлов Н.А. А. М. Бутлеров и его значение в современной химии // Природа. — 1928. — № 12.
5. ↑ Butlerow A. (1861). «Einiges ü ber die chemische Structur der Kö rper. (Vorgetragen in der chemischen Section der 36. Versammlung deutscher Naturforscher und Aerzte zu Speyer am 19.Septbr.)». Zeitschrift fü r Chemie und Pharmacie 4: 549-560.
6. ↑ Бутлеров А. О химическом строении веществ // Учёные записки Казанского университета (отд. физ.-мат. и мед. наук). Вып.1, отд.1. — 1862. — С. 1—11.
7. ↑ Соч., т. 1, 1953, с. 561
8. ↑ Соч., т. 1, 1953, с. 70
9. ↑ Информация о научных событиях на сайте журнала «Успехи химии»
10. ↑ Сайт Бутлеровского конгресса
Литература[править | править вики-текст]
· А. М. Бутлеров. 1828—1928: Сборник статей. — Л., 1929.
· Гумилевский Л. И. Бутлеров. — М.: Молодая гвардия, 1951. — 336 с. — (ЖЗЛ).
· Быков Г. В. Александр Михайлович Бутлеров. — М., 1961.
· Быков Г. В. История классической теории химического строения. — М., 1960.
· Марковников В. В. Московская речь о Бутлерове // Труды института истории естествознания и техники. — 1956. — Т. 12. — С. 135—181.
· Мельников Н. М. Об исследованиях А. М. Бутлерова фауны местного края // В кн.: Торжественное публичное заседание Совета Императорского Казанского университета, посвященное памяти его покойного почётного члена, академика А. М. Бутлерова, 5 февраля 1887 г. Казань, 1887. — С. 62—67.
· Письма русских химиков к А. М. Бутлерову // Научное наследство. — Т. 4. — М., 1961.
· Книга для чтения по органической химии. Пособие для учащихся. М., " Просвещение", 1975.
· А. М. Бутлеров. Избранные работы по органической химии. М., Изд-во АН СССР, 1951.