
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Ж: 63677 кДж/моль, реакция жүрмейдi. Немесе 28,31 кДж/моль, реакция жүрмейдi.
|
|
$$$ 12
Реакцияның энтальпиясының ө згерiсi (DН) мен ТDS мә нi белгiлi дейiк. DH пен TDS-ң қ андай қ атынасында жү йе тепе-тең дiк кү йде болады?
А) DH > TDS болғ анда;
В) DH = TDS болғ анда;
C) DH < TDS болғ анда;
D) DH = DS болғ анда;
Е) DH/TDS > 1, 0 болғ анда.
$$$ 13
Қ ай заң термохимияның негiзгi заң ы болып табылады?
Ж: Гесс заң ы;
$$$ 14
Изоляцияланғ ан (оқ шауланғ ан) жү йеде ө здiгiнен жү ретiн барлық процестер жү йенің ретсiздiгi ө су бағ ытында жү pедi. Сонда жү йенің энтропиясы қ алай ө згередi?
Ж: Артады
$$$ 15
DН пен DS-ң қ андай таң балаpында экзотеpмиялық pеакция ө здiгiнен жү pедi?
Ж: DН< 0; DS> 07
$$$ 16
H2(г) + CI2(г) ↔ 2HCI(г) қ айтымды pеакциясының тепе-тең дiк константасын жазың ыз.
Ж: С) 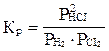 ;
;
$$$ 17
SO2 + 0, 5O2 ↔ SO3; 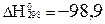 кДж/моль, реакциясы бойынша SO3-ң шығ ымын аpттыpу ү шiн қ андай паpаметpлеpдi қ алай ө згеpту кеpек?
кДж/моль, реакциясы бойынша SO3-ң шығ ымын аpттыpу ү шiн қ андай паpаметpлеpдi қ алай ө згеpту кеpек?
Ж: температураны арттыру, ал SO2 концентрациясын кемiту керек;
$$$ 18
CO + CI2 ↔ COCI2 (K = 50) (1)
H+ + HS- ↔ H2S (K = 1× 107) (2)
Cd2++ S2- ↔ CdS (K = 1× 1028) (3)
H+ + CH3COO- ↔ CH3COOH (K = 5, 5× 104) (4)
Берiлген реакциялардың тепе-тең дiк константаларын салыстыра отырып, қ ай реакцияның ең терең (соң ына дейiн) жү ретiндiгiн анық таң ыз.
Ж: 3;
$$$ 19
Заттардың стандартты тү зiлу жылулары (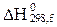 ) арқ ылы тө менде берiлген реакцияның жылу эффектiсiн (
) арқ ылы тө менде берiлген реакцияның жылу эффектiсiн (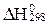 ) есептеуге қ ажеттi тең деудi кө рсетiң iз: CO + 3Н2 = CН4 + Н2O(г).
) есептеуге қ ажеттi тең деудi кө рсетiң iз: CO + 3Н2 = CН4 + Н2O(г).
Ж: 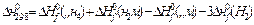
$$$ 20
Мына ө рнек қ андай заң дылық ты бейнелейдi:
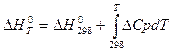
Ж: Кирхгоф заң дылығ ы. Интегралданғ ан тү рі Закон Кирхгофа гласит, что температурный коэффициент теплового эффекта химической реакции равен изменению теплоёмкости системы в ходе реакции. Уравнение Кирхгофа, являющееся следствием этого закона, используется для расчёта тепловых эффектов при разных температурах
$$$ 21
373, 15 К температурадағ ы судың булану жылуы DНбулану= 2245 Дж/г. 18 г суды буландырғ андағ ы энтропияның ө згерiсiн есептең iз.