
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Порядок проведення роботи. Проводять два визначення хлор-іонів: орієнтовне і точне
|
|
Проводять два визначення хлор-іонів: орієнтовне і точне. Якщо за даними орієнтовного визначення вода має багато хлоридів, воду для точного визначення відбирають з таким розрахунком, щоб на одне визначення пішло 3-20 мл 0, 1н розчину азотнокислого срібла.
Орієнтовне визначення: в пробірку наливають 5 мл досліджуваної води, додають одну краплю 10% розчину хромовокислого калію. Потім, постійно перемішуючи, добавляють по краплях 0, 1н розчин азотнокислого срібла до незникаючого бурого кольору. При множенні числа використаних крапель на 0, 02 одержують приблизно склад хлор-іону в розчині, виражений в г/л.
Точне визначення: якщо при орієнтовному визначенні вміст хлор-іону не перевищує 0, 400 г/л, точне визначення проводиться в 100 мл води. При більш високому вмісті хлоридів для визначення відбирають відповідно менший об’єм, або користуються точно розведеним вихідним розчином.
До відміряного об’єму (100 мл) досліджуваної води додають 5 крапель хромату калію і повільно титрують при неперервному перемішуванні 0, 1н розчином азотнокислого срібла до переходу жовтуватого кольору у розовато-бурий, що не зникає при перемішуванні. При титруванні рекомендується порівнювати колір досліджуваної води з кольором стандарту, який готується додаванням повареної солі до відтитрованої проби. Від добавки повареної солі бурий колір розчину переходить в світлий, в зеленувато-жовтий.
Визначення хлоридів за цим методом правильно тільки в тому випадку, коли рН розчину, в якому визначають хлор-іон, не менше 7 і не більше 10, 5.
Якщо рН розчину більше 10, 5, тоді до проби розчину, відібраної для визначення іону хлору, додають 2-3 краплі 0, 1 % розчину фенолфталеїну і по краплях розведену (не менше 1: 5) азотну кислоту для прозорості розчину.
Якщо досліджувана вода має кислу реакцію, то таку пробу нейтралізують 0, 1н розчином їдкого натрію, застосовуючи в якості індикатора той же розчин фенолфталеїну і обезбарвлюють потім воду однією краплею азотної кислоти.
Якщо вода має у собі сірководень, від нього звільняються кип’ятінням її в азотнокислому середовищі.
Кількість хлор-іонів розраховують так:
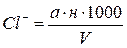 мг-екв/л (2.1)
мг-екв/л (2.1)
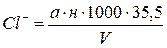 мг/л, (2.2)
мг/л, (2.2)
де а – кількість розчину азотнокислого срібла у мл, витрачене на титрування,
н – нормальність розчину азотнокислого срібла,
V – об’єм проби взятої для титрування (з врахуванням розведення),
35, 5 – еквівалентна вага хлору.