
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Максвелловское распределение частиц газа по скоростям и энергиям.
|
|
В газе молекулы при соударении обмениваются скоростями случайным образом, в результате огромного числа соударений устанавливается стационарное состояние, когда число молекул в заданном интервале скоростей сохраняются постоянными (с точностью до флуктуации). Распределение молекул по скоростям впервые было установлено Максвеллом. Важнейшим макроскопическим параметром, характеризующим распределение молекул по скоростям, является их средняя кинетическая энергия. Это связано с тем, что при взаимодействии различных молекул различных сортов газов происходит выравнивание их средних кинетических энергий.
Рассмотрим фазовое пространство всех скоростей молекул.
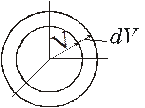
Рисунок 5.5
Г - фазовое пространство;
N - число частиц в системе;
dN - число частиц, попавших в диапазон скоростей от V до V+dV;
P(v) - вероятность, что у частицы скорость v;
DP(v) – вероятность, что скорость находится в интервале от v до 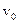 ;
;
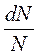 - доля частиц со скоростями: от V до V+dV;
- доля частиц со скоростями: от V до V+dV;
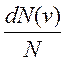 - доля частиц в единичном интервале скоростей вблизи выделенной скорости V, или - вероятность обнаружения частицы с такой скоростью.
- доля частиц в единичном интервале скоростей вблизи выделенной скорости V, или - вероятность обнаружения частицы с такой скоростью.
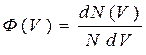 - функция распределения частиц по скоростям.
- функция распределения частиц по скоростям.
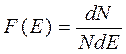 - функция распределения частиц по энергиям.
- функция распределения частиц по энергиям.
Рассмотрим объем слоя сферы фазового пространства.
dГ - объём - элемент слоя фазового пространства скоростей.
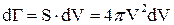 - площадь dv
- площадь dv
элемент объёма пространства скоростей.
j - плотность точек, тогда число точек
N=j dГ
Каждая проекция является суммой случайных величин, удовлетворяющих условию распределения Гаусса.
Закон распределения Гаусса:
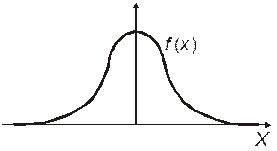
Рисунок 5.6
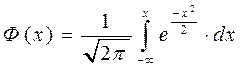
Интегрируя данное выражение, мы получим два условия:
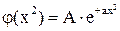 не подходит по физическому смыслу;
не подходит по физическому смыслу;
 подходит по физическому смыслу.
подходит по физическому смыслу.
Применительно к скоростям получим:
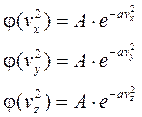
Эти уравнения являются корнями решения нашей функции.
Найдём вероятность того, что проекции скорости попадают в интервал от v до V+dV
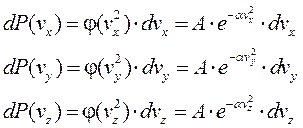
Вероятность того, что скорость молекул попадает в наш объём элемента пространства скоростей, равна произведению вероятностей попадания по осям x, y, z.
Поэтому распишем:
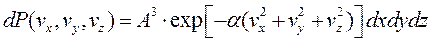
Условие нормировки:
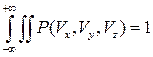 - если событие достоверно вероятность нормировки. Отсюда находим постоянную А, учитывая, что выражение
- если событие достоверно вероятность нормировки. Отсюда находим постоянную А, учитывая, что выражение 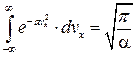 является интегралом Пуассона.
является интегралом Пуассона.
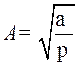
Найдём среднее значение кинетической энергии.
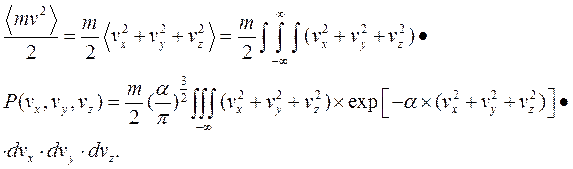
Интегралы найдём посредством дифференцирования.
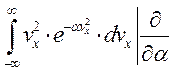
Отсюда следует:
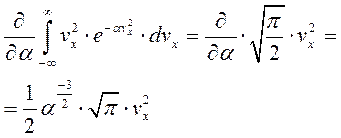
Это мы проведём по всем координатам и подставим:
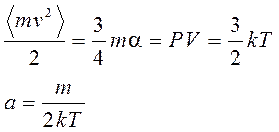
k - постоянная Больцмана.
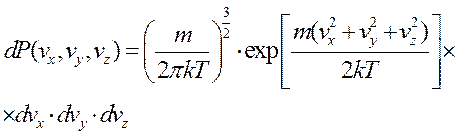
Распределение скоростей изотропное не зависят от направления, поэтому перейдём к распределению модуля скорости. Для этого надо перейти в сферическую систему координат в пространстве скоростей. И проинтегрировать по сферическому слою толщиной dv.
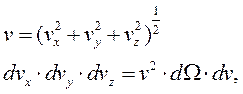 , где
, где
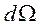 - телесный угол, под которым из начала координат виден элемент поверхности сферического слоя.
- телесный угол, под которым из начала координат виден элемент поверхности сферического слоя.
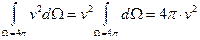
Отсюда можно получить:
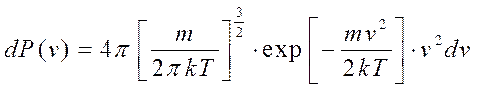
Эта формула даёт вероятность нахождения модуля скорости молекулы в интервале скоростей от v до v+dv.
Функция:
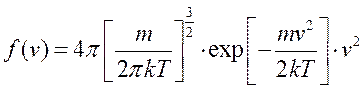 - названа распределением Максвелла. Она является плотностью вероятности того, что молекула имеет модуль скорости равный v.
- названа распределением Максвелла. Она является плотностью вероятности того, что молекула имеет модуль скорости равный v.
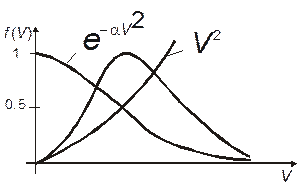
Рисунок 5.7
Распределение Максвелла позволяет найти относительное число молекул, скорости которых заключаются в интервале от v до v+dv.
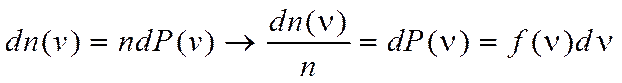
n - количество всех частиц.