
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основы химической термодинамики. Термодинамика химических реакций.
|
|
Лекция
Термодинамика химических реакций.
План лекции:
Основы химической термодинамики. Внутренняя энергия и энтальпия.
Термохимия и термохимические расчеты. Закон Гесса. Следствия из закона Гесса.
Второй закон термодинамики. Энтропия.
Направленность процесса. Энергия Гиббса.
Основы химической термодинамики.
Науку о взаимных превращениях различных видов энергии называют термодинамикой. Химическая термодинамика изучает энергетические эффекты, сопровождающие химические процессы, направление этих процессов и самопроизвольное протекание различных процессов в данных условиях.
Состояние системы характеризуется термодинамическими параметрами: температура, давление, концентрация вещества.
Условия стандартного состояния системы: Т= 298К, р=101, 3 кПа, v = 1 моль.
Термодинамические свойства системы можно выразить с помощью нескольких функций состояния, к особенностям таких функций относится их зависимость только от начального и конечного состояний системы, но не зависимость от пути перехода системы из одного состояния в другое. Все функции состояния относятся к 1 молю вещества.
Рассмотрим следующие функции состояния:
- энтальпия (Н)
- энтропия (S)
- энергия Гиббса (G)
- внутренняя энергия (U)
За исключением энтропии, абсолютное значение указанных функций определить невозможно, можно определить только их изменения.
Внутренняя энергия системы U представляет собой общий её запас, который складывается из энергии поступательного и вращательного движения молекул, энергии внутримолекулярных колебаний атомов и атомных групп, внутриядерной энергии, энергии движения электронов.
Абсолютное значение внутренней энергии определить невозможно, можно определить ее изменение при переходе из начального состояния в конечное, независимо от пути перехода, по которому протекает процесс:
 U = U2 –U1
U = U2 –U1
Изменение внутренней энергии можно измерить с помощью работы (А) и теплоты (Q), т.к. система может обмениваться с внешней средой энергией в форме теплоты и работы. Количественное соотношение между внутренней энергией, теплотой и работой устанавливает I закон термодинамики:
Теплота, подведенная к системе, расходуется на увеличение внутренней энергии системы и на совершение системой работы против внешних сил:
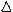 Q = U + А
Q = U + А
Q – теплота или мера энергии передаваемая за счет разницы температур от одного тела к другому путем теплообмена.
А – работа или мера энергии передаваемая за счет массообмена от одного тела к другому.