
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретическая часть. Определение постоянной Ридберга и энергетических уровней атома водорода
|
|
Лабораторная работа № 12
Определение постоянной Ридберга и энергетических уровней атома водорода
Цель работы: Исследование серии Бальмера спектра атома водорода с помощью дифракционной решетки. Определение постоянной Ридберга и энергетических уровней атома водорода.
Теоретическая часть
Строго говоря, энергетические уровни атома водорода 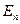 определяются решением квантовых уравнений с кулоновским потенциалом: в нерелятивистском приближении – решением уравнения Шрёдингера, а в релятивистском приближении с учетом спина электрона – решением уравнения Дирака. Вместе с тем эти уровни могут быть определены и с помощью теории Бора атома водорода, хотя эта теория, в частности, дает неточный результат для момента импульса атома в основном состоянии и не позволяет вычислить интенсивность спектральных линий.
определяются решением квантовых уравнений с кулоновским потенциалом: в нерелятивистском приближении – решением уравнения Шрёдингера, а в релятивистском приближении с учетом спина электрона – решением уравнения Дирака. Вместе с тем эти уровни могут быть определены и с помощью теории Бора атома водорода, хотя эта теория, в частности, дает неточный результат для момента импульса атома в основном состоянии и не позволяет вычислить интенсивность спектральных линий.
Полуклассическая теория Бора описывает свойства атома водорода и водородоподобных ионов (один электрон в поле ядра Ze). В основе модели лежат постулаты Бора:
1) Электроны могут двигаться только по определенным стационарным орбитам в соответствии с классическими уравнениями движения и, находясь на этих орбитах, не излучают энергии. Момент импульса электрона на стационарной орбите может принимать только дискретные значения 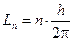 . Для круговых орбит правило квантования принимает вид:
. Для круговых орбит правило квантования принимает вид:
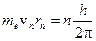
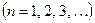 (1)
(1)
2) Излучение или поглощение квантов электромагнитного излучения происходит только при переходе с одной стационарной орбиты на другую:
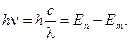 (2)
(2)
Здесь h – постоянная Планка, me – масса электрона, rn и v n – соответственно радиус круговой орбиты с номером n и скорость электрона на этой орбите, ω и λ – циклическая частота и длина волны излучения, с – скорость света в вакууме. Число n называется главным квантовым числом.
Для движения электрона по круговой орбите атома водорода используем правило квантования (1) и уравнение движения (второй закон Ньютона):
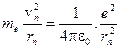 .
.
Из этих уравнений находим радиус n -й орбиты и скорость электрона на ней:
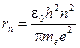 ,
, 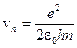 . (3)
. (3)
В этих уравнениях me – масса электрона, e – элементарный заряд, ε 0 – электрическая постоянная. Энергия электрона на n -й орбите:
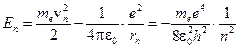 . (4)
. (4)
Длина волны излучения, испускаемого атомом водорода, может быть определена в соответствии с выражением:
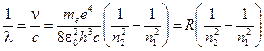 , (5)
, (5)
где величина
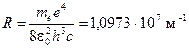 (6)
(6)
называется постоянной Ридберга. 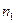 – номер начального состояния,
– номер начального состояния, 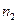 – номер конечного состояния электрона.
– номер конечного состояния электрона.
Формула (5) носит название обобщенной формулы Бальмера. Диаграмма энергетических состояний атома водорода представлена на рис.1. Линии водорода с 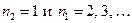 образуют серию Лаймана (ультрафиолетовая область), линии с
образуют серию Лаймана (ультрафиолетовая область), линии с 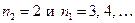 – серию Бальмера (от красной области до ультрафиолетовой), линии с
– серию Бальмера (от красной области до ультрафиолетовой), линии с 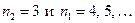 – серию Пашена (инфракрасная область), далее следуют серии линий в инфракрасной области спектра.
– серию Пашена (инфракрасная область), далее следуют серии линий в инфракрасной области спектра.
Отметим, что энергия связи или энергия ионизации – это энергия, которую необходимо сообщить электрону в основном состоянии (n = 1), чтобы удалить его из атома. Для атома водорода получаем
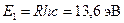 . (7)
. (7)
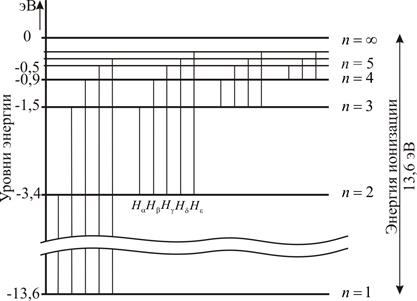
Рис.1. Диаграмма энергетических уровней атома водорода:
- Серия Лаймана – ультрафиолетовая область – переходы на уровень с
 ;
; - Серия Бальмера – от ультрафиолетовой области до красной – переходы на уровень с
 ;
; - Серия Пашена – инфракрасная область – переходы на уровень с
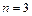 .
.