
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Характеристики процесу набрякання
|
|
Ступінь набрякання визначається кількістю рідини, що поглинається одиницею маси або об’єму сухого зразка полімеру. Визначають ступінь набрякання ваговим або об’ємним методами. Ваговий метод полягає у зважуванні зразка полімеру до і після набрякання. Розраховують ступінь набрякання за формулою:
 100% (23.1)
100% (23.1)
Об’ємний метод визначення ступеня набрякання ґрунтується на вимірюванні об’єму полімеру до і після набрякання:
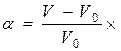 100%, (23.2)
100%, (23.2)
де m 0 і V 0 – маса і об’єм зразка полімеру до набрякання; m і V – маса і об’єм полімеру після набрякання.
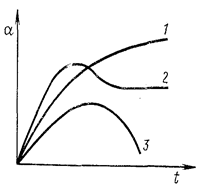
На рис. 23.1 показані криві, що показують зміну ступеню набрякання полімеру з часом. У випадку обмеженого набрякання ступень набрякання досягає максимального значення, після чого залишається сталим. Під час необмеженого набрякання крива проходить через максимум, після чого ступінь набрякання зменшується практично до нуля внаслідок поступового розчинення зразка полімеру.
 Ступінь набрякання ВМС залежить від їх будови і форми макромолекул (найкраще набрякають лінійні ВМС з витягнутими макромолекулами), хімічної природи і фізико-хімічних властивостей розчинника (найкраще полімери набрякають у хімічно спорідненими з ними розчинниках).
Ступінь набрякання ВМС залежить від їх будови і форми макромолекул (найкраще набрякають лінійні ВМС з витягнутими макромолекулами), хімічної природи і фізико-хімічних властивостей розчинника (найкраще полімери набрякають у хімічно спорідненими з ними розчинниках).
Рисунок 23.1– Кінетичні криві набрякання ВМС: 1, 2 – обмежене набрякання; 3 – необмежене набрякання.
Кінетику набрякання описують рівнянням необоротної реакції І порядку:
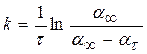 , (23.3)
, (23.3)
де w – швидкість набрякання; at – ступінь набрякання зразка полімеру у момент часу t; a ¥ – максимальний ступінь набрякання зразка; k – константа швидкості набрякання – величина, що залежить від природи полімеру та розчинника.
Геометрично швидкість набрякання визначають за величиною тангенсу кута нахилу дотичної до кривої " a – t ". Швидкість набрякання ВМС суттєво зростає при підвищенні температури, при зменшенні розмірів зразків полімеру, його віку і молярної маси.
23.3 Термодинаміка процесів набрякання ВМС
Набрякання полімерів є самочинним екзотермічним процесом. Тепловий ефект, що супроводжує процес набрякання 1 кг сухого полімеру називається теплотою набрякання. Теплоту набрякання визначають дослідним шляхом для кожної пари " полімер-розчинник". Так, під час набрякання желатину у воді виділяється ~28 кДж/кг, крохмалю – ~32, 3 кДж/кг.
Під час набрякання теплота виділяється тільки під час поглинання полімером перших порцій рідини. Це означає, що на першій стадії набрякання має місце міжмолекулярна взаємодія макромолекул полімеру і молекул розчинника, інше кажучи йде процес сольватації полімеру. На другій стадії набрякання має місце звичайна дифузія молекул розчинника в об’єм полімеру, яка тепловими ефектами не супроводжується. Відповідно розрізняють дві форми існування розчинника, наприклад води, у біополімерах – це зв’язана вода і вільна (капілярна) вода.
Процеси набрякання відіграють велику роль у метаболізмі тварин: усі білки в організмі тварин знаходяться у набряклому стані; проростання зерен або їх кулінарна обробка теж починається з процесу набрякання.
Лекція №24
Фізико-хімічні властивості розчинів ВМС
План лекції
1. Реологічні властивості розчинів ВМС. Закон Ньютона. Віскозиметрія.
2. Драглі. Фізико-хімічні властивості драглів. Синерезис драглів.
3. Поліелектроліти. Дисоціація поліелектролітів. Ізоелектрична точка. Фізико-хімічні властивості поліелектролітів.
Рекомендована література: [1] С. 516-520, [2] С.121-127, [3] С.157-168.
24.1 Реологічні властивості розчинів ВМС
Наука, що вивчає закономірності деформації і плину тіл під дією механічного навантаження називається реологією. Закон в'язкого плину рідин відкрив Ньютон: " Сила внутрішнього тертя, що виявляється під час взаємного переміщення шарів рідини, прямо пропорційна градієнту відносної швидкості цього переміщення і площині поверхні шарів". Математично закон записується так:
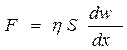 , (24.1)
, (24.1)
де F – сила тертя, що діє на поверхню шару рідини у напрямку протилежному його руху; w – відносна швидкість шарів рідини площиною S, що знаходяться на відстані х; h – коефіцієнт пропорційності, який називають в'язкістю.
В'язкість можна визначити, як опір рідини взаємному переміщенню її шарів. Вимірюють в'язкість у пуазах, 1 Пз = Н/м× с.
Розділ реології, що вивчає в'язкість рідин називається віскозиметрією. Прилади для вимірювання в'язкості називаються віскозиметрами. Найпоширеніші з них – капілярні, в яких в’язкість визначають за об’ємом рідини, що витікає за певний проміжок часу через капілярну трубку. Для характеристики реологічних властивостей розчинів ВМС застосовують такі величини:
· відносна в’язкість – відношення в'язкості розчину до в'язкості розчинника;
· питома в’язкість – відношення збільшення в'язкості розчину порівняно з розчинником до в'язкості самого розчинника;
· приведена в’язкість – питома в'язкість приведена до одиниці концентрації розчину ВМС;
· характеристична в’язкість, яка являє собою приведену в’язкість за нескінченного розбавлення розчину ВМС.
Дослідження в’язкості розбавлених розчинів полімерів дає непряму інформацію про їх молярну масу. Залежність характеристичної в’язкості розчинів ВМС від їх молярної маси характеризується рівнянням Марка-Хаувінка:
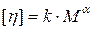 , (24.2)
, (24.2)
де k – константа, характерна для кожного гомологічного ряду; a - коефіцієнт, що враховує ступень гнучкості ланцюгів ВМС.
24.2 Драглі
Витягнені і гнучкі макромолекули ВМС здатні злипатися між собою внаслідок міжмолекулярної взаємодії. У результаті утворюються довгі ланцюги, що пронизують весь об’єм рідини. Така система подібна до тривимірній просторовій сітки, що містить у собі нерухому рідину (див. рис. 24.1). Утворення зв'язків між макромолекулами впливає на реологічні властивості розчинів ВМС: закон Ньютона для них не виконується, тобто їх в’язкість не є величиною сталою і залежить від швидкості плину рідини. Так за низьких швидкостей руху рідини, зчеплення між макромолекулами встигає відновитися і в’язкість системи виявляється дуже 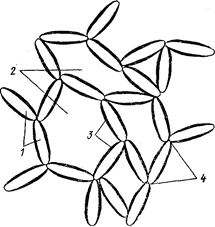 значною. Висока швидкість руху рідини заважає відновленню зв’язків між її макромолекулами, зменшуючи об’єм нерухомої рідини і відповідно в’язкість системи. На реологічних кривих для таких систем спостерігають дві ділянки з сталою величиною в’язкості. Одна з них відповідає незруйнованій структурі макромолекул ВМС, друга – повністю зруйнованій.
значною. Висока швидкість руху рідини заважає відновленню зв’язків між її макромолекулами, зменшуючи об’єм нерухомої рідини і відповідно в’язкість системи. На реологічних кривих для таких систем спостерігають дві ділянки з сталою величиною в’язкості. Одна з них відповідає незруйнованій структурі макромолекул ВМС, друга – повністю зруйнованій.
Рисунок 24.1– Утворення просторових структур: 1 – макромолекули; 2 – рідина, що укладена в елементах структури; 3 – захисні шари; 4 – ділянки позбавлені захисних шарів
За наявності великого числа зв’язків між макромолекулами ВМС плин їх розчинів стає зовсім неможливим: під дією зовнішніх сил у них спостерігається лише пружна деформація, тобто структуровані системи ведуть себе подібно твердим тілам. Загальноприйнята назва таких систем – драглі. Драглі – це структуровані розчини ВМС з властивостями еластичних твердих тіл. Драглі одержують шляхом застиганням розчинів полімерів, яке полягає в об’єднанні макромолекул у формі сітки, або обмеженим набряканням сухих ВМС у відповідних розчинниках.
На процес утворення драглів істотно впливає природа ВМС, концентрація, температура, наявність у розчинах домішок інших речовин. У концентрованих розчинах здатність ВМС драгліти посилюється внаслідок зменшення відстані між макромолекулами. Здатність драгліти збільшується і при зниженні температури, оскільки при цьому зменшується рухливість часточок, полегшуючи їх зчеплення.
Драглі можуть виявляти властивості характерні, як для твердих тіл, так і для рідин. Так, вони подібно твердим тілам здатні зберігати свою форму, виявляють пружні та еластичні властивості. Більшість драглів здатні розріджуватися і переходити у розчин при механічній дії на них. Цей процес зворотний, оскільки у стані спокою через певний проміжок часу розчин знову драгліє. Властивість драглів багаторазово ізотермічно розріджуватися при механічній дії і драгліти у стані спокою називають тиксотропією.
Драглі містять значну кількість рідини, тому в них можуть відбуватися процеси дифузії. Механізм і швидкість дифузії низькомолекулярних речовин у драглях не відрізняється від їх дифузії у відповідних розчинниках.
Під час тривалого зберігання драглі зазнають суттєвих змін, оскільки процес структурування в драглях не припиняється після їх утворення. На поверхні драглів з’являються краплини рідини, які зливаючись утворюють рідке середовище, що являє собою розбавлений розчин ВМС. Самочинний процес поділу драглів на дві фази, що супроводжується зменшенням об’єму драглів, називають синерезисом. Драглі, стискуючись у процесі синерезису, зберігають форму тієї посудини, в яку були налиті рідини до застигання
24.3 Поліелектроліти
ВМС, що містять функціональні групи, які здатні дисоціювати під час розчинення, називають поліелектролітами. У залежності від природи іоногенних груп поліелектроліти можна поділити на три категорії:
· кислотні, які містять значну кількість карбоксильних груп (--СООН) або сульфат-груп (--SО3Н), наприклад альгінат, агар-агар тощо;
· основні, що містять функціональні групи, які виявляють основні властивості, наприклад аміногрупи (--NH2);
· амфотерні, що містять одночасно як кислотні, так і основні функціональні групи – насамперед білки. Під час розчинення білків відбувається дисоціація їх функціональних груп:
R--СOOH ⇄ R--СOO– + H+;
R--NH2 + H2O ⇄ (R--NH3)+ + OH–.
де R – поліпептидний ланцюг білку.
Заряд макромолекули білка залежить від співвідношення в ній числа кислотних і основних груп, їх ступенів дисоціації і рН середовища. У кислому середовищі посилюється дисоціація аміногруп і уповільнюється карбоксильних груп. Внаслідок чого макромолекули білків у кислому середовищі заряджаються позитивно, а у лужному середовищі навпаки – негативно. Змінюючи рН розчину можна створити умови, за яких заряд макромолекул буде дорівнювати нулю. Такий стан молекул називають ізоелектричним. Значення рН розчину, за якого молекула ВМС стає незарядженою, називається ізоелектричною точкою (ІЕТ).
 Залежність властивостей розчинів поліелектролітів від рН середовища носить складний характер. Найбільш різка зміна властивостей має місце поблизу ІЕТ. На рис.24.2. приведена залежність відносної в’язкості розчину желатину від рН. Можна бачити, що найменше значення в’язкості розчину відповідає ізоелектричному стану желатину (рН = 4, 75). В ізоелектричному стані макромолекули білків згорнуті у щільні клубки які, внаслідок свого малого об’єму, не перешкоджають плину розчину. Таку ж залежність від рН мають ступінь набрякання білків і осмотичний тиск їх розчинів.
Залежність властивостей розчинів поліелектролітів від рН середовища носить складний характер. Найбільш різка зміна властивостей має місце поблизу ІЕТ. На рис.24.2. приведена залежність відносної в’язкості розчину желатину від рН. Можна бачити, що найменше значення в’язкості розчину відповідає ізоелектричному стану желатину (рН = 4, 75). В ізоелектричному стані макромолекули білків згорнуті у щільні клубки які, внаслідок свого малого об’єму, не перешкоджають плину розчину. Таку ж залежність від рН мають ступінь набрякання білків і осмотичний тиск їх розчинів.
Рисунок 24.2 – Залежність в’язкості водного розчину желатини від рН
Рекомендована до дисципліни література
1. Киреев, В. А. Курс физической химии [Текст] / В. А. Киреев. – 5-е изд. – М.: Высшая школа, 1985. – 620 с.
2. Савгіра, Ю. О. Фізична та колоїдна хімія [Текст]: Навчальний посібник / Ю.О.Савгіра, С. О. Самойленко, О. В. Добровольська, О. Ф. Аксенова. – Харків: ХДУХТ, 2006.– 162 с.
3. Ліпатніков, В. Є. Фізична та колоїдна хімія [Текст] / В. Є. Ліпатніков, К.М.Казаков. – Київ: Вища школа, 1993. – 197 с.
4. Романова, Н. В. Загальна та неорганічна хімія [Текст] / Н. В. Романова. – Київ: Ірпинь, 1998. – 480 с.