
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Окислительное и восстановительное действие тока во много раз сильнее действия химических восстановителей и окислителей.
|
|
Электролиз расплавов (если не учитывать трудности, связанные с высокой температурой) протекает просто: с момента подачи напряжения на электродах протекают процессы окисления и восстановления ионов, образовавшихся при плавлении электролита.
Если в расплаве находится смесь ионов различных электролитов, то порядок их разрядки на электродах определяется их электродными потенциалами в данных условиях: так как на катоде идет реакция восстановления, т.е. прием электронов окислителем, то в первую очередь должны реагировать наиболее сильные окислители (т.е. восстанавливаются катионы в порядке убывания Ео). На аноде протекают реакции окисления восстановителей, т.е. отдача электронов восстановителями. Поэтому в первую очередь на аноде должны реагировать наиболее сильные восстановители – вещества, имеющие наиболее отрицательный потенциал.
При электролизе выполняется закон сохранения электрического заряда: число электронов, отданных на аноде, должно равняться числу электронов, присоединенных на катоде.
 При составлении схемы электролиза:
При составлении схемы электролиза:
- записывают уравнение диссоциации электролита и определяют в каком порядке разряжаются ионы на электродах;
- записывают уравнения процессов на аноде и катоде и умножают их на наименьшие множители для установления равенства отданных и присоединенных электронов;
- суммируют полученные уравнения и получают ионно-молекулярное уравнение электролиза;
- 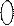 на основании ионно-молекулярного уравнения составляют молекулярные уравнения электролиза.
на основании ионно-молекулярного уравнения составляют молекулярные уравнения электролиза.
На основании схемы и молекулярного уравнения электролиза устанавливают, какие вещества разлагаются, какие выделяются на аноде и катоде, и какие вещества накапливаются в электролизере.
Катионы наиболее активных металлов (от Li+ до Al3+ включительно), а также анионы SO42-, NO3-, CO32-, PO43-, MnO4- и F- разряжаются на электродах только при электролизе расплавов.
Рассмотрим несколько примеров электролиза в расплаве.
Пример. Электролиз расплава NaCl
NaCl → Na+ + Cl-
 K(-): Na+ +
K(-): Na+ +  = Naо 2
= Naо 2
A(+): 2Cl- - 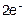 = Cl2↑ 1
= Cl2↑ 1
 |
2Na+ + 2Cl- → 2Na + Cl2↑ ионно-молекулярное уравнение
2NaCl  2Na + Cl2↑ молекулярное уравнение
2Na + Cl2↑ молекулярное уравнение
На поверхности катода образуется слой металлического натрия, а на аноде выделяется газообразный хлор.
Пример. Электролиз расплава КОН
КОН → К+ + ОН-
 K(-): К+ +
K(-): К+ +  = Ко 4
= Ко 4
A(+): 4ОН- - 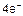 = 2Н2О↑ + О2↑ 1
= 2Н2О↑ + О2↑ 1
 |
2К+ + 4ОН- → 4К + 2Н2О↑ + О2↑ ионно-молекулярное уравнение
4КОН 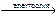 4К + 2Н2О↑ + О2↑ молекулярное уравнение
4К + 2Н2О↑ + О2↑ молекулярное уравнение
Пример. Электролиз расплава Na2CO3
 Na2CO3 → 2Na+ + CO32-
Na2CO3 → 2Na+ + CO32-
K(-): Na+ +  = Naо 4
= Naо 4
 A(+): 2CO32- -
A(+): 2CO32- - 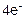 = 2CО2↑ + О2↑ 1
= 2CО2↑ + О2↑ 1
4Na+ + 2CO32-→ 4Na + 2CО2↑ + О2↑ ионно-молекулярное уравнение
2Na2CO3 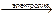 4Na + 2CО2↑ + О2↑ молекулярное уравнение
4Na + 2CО2↑ + О2↑ молекулярное уравнение
Пример. Электролиз расплава Na2SO4
Na2SO4 → 2Na+ + SO42-
 K(-): Na+ +
K(-): Na+ +  = Naо 4
= Naо 4
 A(+): 2SO42- -
A(+): 2SO42- - 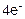 = 2SО3↑ + О2↑ 1
= 2SО3↑ + О2↑ 1
4Na+ + 2SO42-→ 4Na + 2SО3↑ + О2↑ ионно-молекулярное уравнение
2Na2SO4 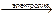 4Na + 2SО3↑ + О2↑ молекулярное уравнение
4Na + 2SО3↑ + О2↑ молекулярное уравнение
Для электролиза в расплаве используют вещества, которые плавятся без разложения.
Методом электролиза расплавов получают главным образом легкие металлы (алюминий, натрий, кальций, барий и т.д.), которые нельзя получить из растворов. Все эти металлы – сильнейшие восстановители, их выделение требует дорогой технологии: электролиза расплава солей, использования других щелочных металлов как восстановителей или высокотемпературной металлотермии.
| Металл | Метод получения |
| Литий Натрий Калий | Электролиз расплава LiCl + KCl Электролиз расплава NaCl Взаимодействие KCl с Na при 850оС |
| Бериллий Магний Кальций | Электролиз расплава BeCl2 2MgCaO2 + FeS = Mg + Fe + Ca2SiO4 Электролиз расплава CaCl2 |
| Алюминий Олово | Электролиз расплава А12О3 в криолите SnO2 + C = Sn + CO2 |
| Свинец | 2PbS + 3O2 = 2PbO + 2SO2 2PbO + C = 2Pb + CO2 |
| Цинк | 2ZnS + 3O2 = 2ZnO + 2SO2 2ZnO +C = 2Zn + CO2 |
| Ртуть | HgS + O2 = Hg + SO2 |
| Титан | TiO2 + 2C + 2Cl2 = TiCl4 + 2CO TiCl4 + 2Mg = 2MgCl2 + Ti |
| Хром | FeCr2O4 + 4C = Fe + 2Cr + 4CO |
| Молибден | 2MoS2 + 7O2 = 2MoO3 + 4SO2 MoO3 + 3H2 = Mo + 3H2O |
| Вольфрам | CaWO4 + 2HCl = WO3 + CaCl2 + H2O 2WO3 + 6H2 = 2W + 6H2O |
| Марганец | MnO2 + C = Mn + CO2 |
| Железо | Fe2O3 + 3CO = 2Fe + 3CO2 |
| Никель | 2NiS + 2O2 = 2Ni + 2SO2 |
| Медь | 2CuFeS2 + 2SiO2 + 5O2 = 2Cu + 2FeSiO3 + 4SO2 |
При электролизе водных растворов электролитов на электродах наряду с разряжением катионов и анионов или вместо них могут восстанавливаться или окисляться молекулы воды. Чтобы определить, какие частицы участвуют в катодном процессе нужно воспользоваться рядом стандартных электродных потенциалов. В зависимости от значения электродного потенциала возможны три варианта протекания катодного процесса:
1.Если в растворе содержатся катионы, например K+, Ca2+, Al3+
(E0 < -1, 18 В), то они не будут восстанавливаться в водном растворе, т.к. легче них восстанавливаются молекулы воды:
2H2O + 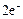 = 2OH- + H2
= 2OH- + H2
2.Если в растворе содержатся ионы, потенциал которых больше нуля (E0 > 0, 0 В), то они легко восстанавливаются на катоде, например:
Cu2+ +  = Cuо
= Cuо
3.В растворе, содержащем ионы, значение стандартного потенциала которых находится в интервале от -1, 18 В до 0, 0 В, при электролизе протекает параллельно два процесса – восстановление катионов металла и молекул воды, например:
Cd2+ +  = Cdо
= Cdо
2H2O +  = 2OH- + H2
= 2OH- + H2
При этом большая часть из всего количества электричества расходуется на восстановление ионов металла.
В анодном процессе могут принимать участие только анионы Cl-, Br-, I-, S2-, OH-. Если в растворе присутствуют другие анионы, то окислению подвергается вода:
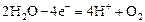
Следовательно, использовать процессы электролиза растворов для получения металлов можно только в том случае, если в растворе имеются катионы, способные разряжаться на катоде.
Пример. Электролиз раствора CuSO4 (инертные электроды)
CuSO4 → Cu2+ + SO42-
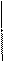 K(-): Cu2+ +
K(-): Cu2+ + 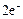 = Cuо 2
= Cuо 2
A(+): 2Н2О - 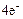 = 4Н+ + О2↑ 1
= 4Н+ + О2↑ 1
 |
2Cu2+ + 2Н2О → 2Cu + 4Н+ + О2↑
После добавления в обе части ионно-молекулярного уравнения катионов 2SO42- получаем:
 2Cu2+ + 2SO42- + 2Н2О → 2Cu + 2SO42- + 4Н+ + О2↑
2Cu2+ + 2SO42- + 2Н2О → 2Cu + 2SO42- + 4Н+ + О2↑
2CuSO4 2Н2SO4
Молекулярное уравнение электролиза:
2CuSO4 + 2Н2О 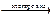 2Cu + 2Н2SO4 + О2↑
2Cu + 2Н2SO4 + О2↑
На катоде выделяется металлическая медь, на аноде – кислород, в электролизере (в анодном пространстве) накапливается серная кислота.
Если анод растворимый, т.е. изготовлен из Cu, Ag, Zn, Ni, Fe и других металлов (кроме Pt и Au), то, независимо от природы аниона, всегда идет окисления атомов металла из которого изготовлен анод:
Meо -  = Men+
= Men+
Образовавшиеся при этом катионы металла переходят в раствор. Масса анода уменьшается, отсюда и его название – растворимый. Анионы остаются в растворе. На катоде катионы металла разряжаются.
Пример. Электролиз раствора Cd(NO3)2 (анод растворимый – Cd)
 K(-): Cd2+ +
K(-): Cd2+ + 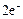 = Cdо 1
= Cdо 1
 A(+): Cdо -
A(+): Cdо - 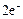 = Cd2+ 1
= Cd2+ 1
Cdо + Cd2+ 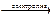 Cdо + Cd2+
Cdо + Cd2+
Так как все ионы сокращаются, то составить молекулярное уравнение электролиза нитрата кадмия невозможно. Это означает, что электролиз раствора Cd(NO3)2 с анодом из кадмия сводится к переносу кадмия с анода на катод.
Процессы, протекающие на катоде при электролизе водных растворов электролитов
| Катионы металлов средней активности | Катионы активных металлов |
| Восстанавливаются совместно с молекулами воды Me+n + ne = Me0 2H2O + 2ē = 2OH- + H2↑ | Не восстанавливаются. Идет восстановление молекул воды 2H2O + 2ē = 2OH- + H2↑ |
| Катионы водорода Н+ Восстанавливаются только при электролизе растворов кислот 2H+1 + 2e = H2 | Катионы малоактивных металлов Восстанавливаются только катионы металлов Me+n + ne = Me0 |
Процессы, протекающие на аноде при электролизе водных растворов электролитов
| Анод нерастворимый (инертный) | |
| Анионы бескислородных кислот (I-, Br-, S-2, Cl-) Окисляются 2Cl- – 2ē = Cl2↑ | Анионы кислородных кислот (оксокислот) Окисляются молекулы воды 2H2O – 4ē = 4H+ + O2↑ |
| Анионы ОН- Окисляются только при электролизе растворов щелочей 4OH- - 4e = O2 + 2H2O | Анионы F- Окисляются только молекулы воды 2H2O – 4ē = 4H+ + O2↑ |
| Анод растворимый(активный) | |
| Анионы не окисляются. Идет окисление атомов металла. Катионы металла переходят в раствор, масса анода уменьшается. Me0 – ne = Me+n |
Современной полупроводниковой и атомной технике необходимы металлы весьма высокой чистоты (содержащие примеси порядка 10-8 %). Важнейшими методами глубокой очистки металлов являются зонная плавка, разложение летучих соединений металлов, переплавка металлов в вакууме и др.
Получение неметаллов:
Основным сырьем для промышленного получения водорода Н2 являются газообразные, жидкие и твердые горючие ископаемые и вода.
Конверсия метана с водяным паром:
СН4 + Н2О = СО + 3Н2 (температура 700-8000С, катализатор никель, оксид алюминия)
Газификация твердого топлива (получение «водяного газа»):
С(уголь) + Н2О = СО + Н2
Электролиз воды в присутствии электролита:
2Н2О = 2Н2 + О2
Электролиз разбавленных растворов хлоридов щелочных металлов:
2NaCl + 2H2O = H2 + Cl2 + 2NaOH
В лаборатории водород получают взаимодействием активных металлов с разбавленными растворами соляной или серной кислот:
Zn + 2HCl = ZnCl2 + H2
Взаимодействием щелочных и щелочноземельных металлов с водой:
Ca + 2H2O = CaOH)2 + H2
Взаимодействием амфотерных металлов со щелочами:
2Al + 2NaOH + 6H2O = Na[Al(OH)4] + 3H2
Взаимодействием кремния с раствором щелочи:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Действием воды на гидриды металлов:
CaH2 + 2H2O = 2H2 + Ca(OH)2
В природных соединениях галогены находятся в основном в виде отрицательно заряженных ионов, поэтому почти все способы получения галогенов в свободном состоянии сводятся к окислению их ионов с помощью сильных окислителей или действием электрического тока.
В промышленности фтор получают электролизом расплава фторидов. Фтор, получаемый таким способом, почти не содержит примесей и дальнейшей очистке не подвергается.
Окислительная активностьгалогенов последовательно уменьшается от фтора к астату. Этот эффект проявляется в способности более легких галогенов в виде простых веществ окислять галогенид-ион более тяжелых галогенов и в способности более тяжелых галогенов восстанавливать кислородные соединения более легких галогенов:
F2 + 2KCl = 2KF + Cl2
Cl2 + 2KBr = 2KCl + Br2
Br2 + 2NaI = 2NaBr + I2
I2 + 2KClO3 =2KIO3 + Cl2
Хлор получают в больших количествах путем электролиза водных растворов (или расплавов) хлоридов натрия и калия.
В лабораториях хлор получают действием различных окислителей на концентрированную соляную кислоту. Часто окислителями служат оксид марганца (IV) MnO2, хромат калия K2CrO4, дихромат калия K2Cr2O7, хлорат калия KClO3, перманганат калия KMnO4 и др.:
2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
mnO2 + 4HCl = Cl2 + MnCl2 + 2H2O
KClO3 + 6HCl = 3Cl2 + KCl + 3H2O
K2Cr2O7 + 14HCl = 3Cl2 + 2CrCl3 + 2KCl + 7H2O
Хлор, получаемый в лаборатории, может быть загрязнен кислородом, парами воды, хлороводорода. Для очистки хлор пропускают через воду и высушивают.
Бром и иод получают из бромидов или иодидов, действуя на них окислителями. Наиболее часто используют для этих целей хлор:
2NaBr + Cl2 = 2NaCl + Br2
2NaI + Cl2 = 2NaCl + I2
К основным загрязнениям брома относятся хлор и иод. Примесь хлора устраняют, действуя ионами брома. Примесь иода удалить из брома трудно. Получение иода не представляет затруднений. Продукт удовлетворительной чистоты получают после двух-, трехкратной возгонки.
Мировое производство фтора измеряется тысячами тонн в год. Примерно половина этого количества расходуется на перевод урана в гексафторид UF6, который затем разделяют на изотопы. Фтор применяют для получения гексафторида серы SF6, фторорганических материалов: фторопластов, световодов для оптической электроники, высокотемпературных ионных проводников.
Ежегодно в мире производится ~ 50 млн. т хлора, который используется в качестве сильного и недорогого окислителя при отбеливании целлюлозы, в органическом синтезе, при обеззараживании питьевой воды, для получения красителей, фотоматериалов и лекарств. Бром является сырьем для синтеза броморганических веществ, бромоводорода, бромидов и броматов. Основное применение йода и его соединений связано с фармацевтической промышленностью, медициной и фотографией.
Кислород образуется в природе в процессе фотосинтеза:
mCO2 + nH2O = mO2 + Cm(H2O)n
В промышленности кислород получают:
Ректификацией жидкого воздуха (отделение от азота).
Электролизом воды:
2H2O = 2H2 + O2
В лабораторных условиях для получения кислорода используют разложение (окислительно-восстановительное) различных солей:
2KClO3 = 3O2 + 2KCl
2KMnO4 = O2 + MnO2 + K2MnO4
2KNO3 = 2KNO2 + O2
В замкнутых помещениях кислород получают (регенерация воздуха), используя пероксиды щелочных металлов:
2Na2O2 + 2CO2 = O2 + 2Na2CO3
Кислород – сильный окислитель. Находит применение при обжиге различных минералов для получения оксидов металлов, которые подвергают восстановлению и получают свободные металлы.
Сера весьма распространенный на земле элемент. Общее содержание серы в земной коре составляет ~ 4, 2·10-2 % по массе. В природе сера встречается как в самородном состоянии, так и в различных органических и неорганических соединениях. Основными природными соединениями являются сульфидные или сернистые руды (FeS2 — пирит, HgS — киноварь, ZnS — цинковая обманка, Cu2S — халькозин, PbS — галенит или свинцовый блеск и др.) и сульфатные или сернокислые руды (Na2SO4·10H2O — мирабилит или глауберова соль, CaSO4·2H2O — гипс, BaSO4 — тяжелый шпат и др.). Соединения серы входят в состав горючих ископаемых (углей, нефти, природного газа), содержатся в морской воде и минеральных источниках. В растениях сера накапливается в листьях и стеблях. В живых организмах входит в состав белков, липидов, некоторых витаминов и биорегуляторов.
Самородную серу очищают от примесей возгонкой или выплавляют перегретым водяным паром. Для получения серы также широко используются химические методы:
- окисление сероводорода:
2H2S + O2 = 2S + 2H2O
2H2S + SO2 = 3S + 2H2O
- восстановление сернистого газа:
2SO2 + CS2 = 6S + 2CO2
Для получения серы из сульфатов используют следующие химические процессы:
- сульфат кальция нагревают с коксом:
4C + CaSO4 = CaS + 4CO
- на полученный сульфид кальция действуют углекислым газом и водой:
CaS + CO2 + H2O = H2S + CaCO3¯
- выделяющийся сероводород окисляют кислородом воздуха:
2H2S + O2 = 2S + 2H2O
Ежегодное мировое потребление серы составляет около 20 млн. т. Почти половина добываемой серы идет на получение серной кислоты. Большое количество серы идет на вулканизацию каучука: каучук приобретает повышенную прочность и упругость. Серу используют в производстве спичек, пороха, пиротехнических составов.
Прием внутрь небольших количеств серы регулирует обмен веществ, способствует заживлению нарывов. Мелкодисперсная (осажденная) сера входит в состав ряда лечебных мазей, которые используют для лечения кожных покровов и волос.