
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Принцип работы свинцового аккумулятора
|
|
Свинцовые аккумуляторы являются вторичными химическими источниками тока, которые могут использоваться многократно. Активные материалы, израсходованные в процессе разряда, восстанавливаются при последующем заряде.
Простейший аккумулятор состоит из емкости с помещенными в нее двумя свинцовыми пластинами, не соприкасающимися друг с другом. В сосуд заливается электролит, состоящий из дистиллированной воды с добавлением химически чистой серной кислоты в определенной пропорции. Уровень электролита должен превышать высоту пластин, что обеспечивает полное использование их поверхности. Подготовленный таким образом аккумулятор заряжается от источника постоянного тока − генератора путем соединения одной пластины с положительным, а другой − с отрицательным полюсом (рис. 2, а).
При прохождении тока через пластины и электролит (заряд) в аккумуляторе происходит процесс преобразования электрической энергии в химическую, что выражается в образовании налета активной массы на поверхности пластин. На положительной пластине образуется перекись свинца коричневого цвета, а на отрицательной − губчатый свинец серого цвета. При этом плотность электролита значительно увеличивается − аккумулятор зарядился. Напряжение заряженного аккумулятора составляет 2 В.
При включении в цепь аккумулятора какого-либо потребителя (лампы) происходит обратный процесс превращения химической энергии в электрическую, и аккумулятор постепенно разряжается. При этом активная масса на той и другой пластинах превращается в сернокислый свинец (рис. 2, б ), а плотность электролита уменьшается. После полного разряда аккумулятор снова заряжается и работоспособность его восстанавливается.
Для увеличения емкости аккумулятора (запаса электроэнергии)
в нем устанавливают большое количество решетчатых пластин, заполненных активной массой и составляющих два полублока (рис. 2, в).
При этом для изоляции между положительными и отрицательными
пластинами устанавливаются сепараторы.
Аккумуляторная батарея состоит из шести свинцово-кислотных двухвольтовых аккумуляторов, соединенных между собой последовательно, что обеспечивает получение в электрической цепи рабочего напряжения 12 В, необходимого для питания всех потребителей на автомобиле.
Рассмотрим более поле подробно работу аккумулятора. Аккумулятор представляет собой совокупность реагентов (окислителя и восстановителя) и электролита. Восстановитель (отрицательный электрод) электрохимической системы в процессе токообразующей реакции отдает электроны и окисляется, а окислитель (положительный электрод) восстанавливается. Электролит обладает хорошей ионной и малой электронной проводимостью.
В свинцовом аккумуляторе в токообразующих процессах участвуют двуокись свинца (диоксид свинца) РbО2 (окислитель) положительного электрода, губчатый свинец Рb (восстановитель) отрицательного электрода и электролит (водный раствор серной кислоты Н2S04). Активные вещества электродов представляют собой относительно жесткую пористую электронопроводящую массу с диаметром пор 1, 5 мкм у РbО2 и 5-10 мкм у губчатого свинца. Объемная пористость активных веществ в заряженном состоянии - около 50%.
Часть серной кислоты в электролите диссоциирована на положительные ионы водорода Н+ и отрицательные ионы кислотного остатка 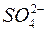 . Губчатый свинец при разряде аккумулятора выделяет в электролит положительные ионы двухвалентного свинца Рb2+. Избыточные электроны отрицательного электрода по внешнему участку замкнутой электрической цепи перемещаются к положительному электроду, где восстанавливают четырехвалентные ионы свинца Рb4+ до двухвалентного свинца Рb2+. Положительные ионы свинца Рb2+ соединяются с отрицательными ионами кислотного остатка
. Губчатый свинец при разряде аккумулятора выделяет в электролит положительные ионы двухвалентного свинца Рb2+. Избыточные электроны отрицательного электрода по внешнему участку замкнутой электрической цепи перемещаются к положительному электроду, где восстанавливают четырехвалентные ионы свинца Рb4+ до двухвалентного свинца Рb2+. Положительные ионы свинца Рb2+ соединяются с отрицательными ионами кислотного остатка 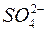 , образуя на обоих электродах сернокислый свинец Рb S04 (сульфат свинца).
, образуя на обоих электродах сернокислый свинец Рb S04 (сульфат свинца).
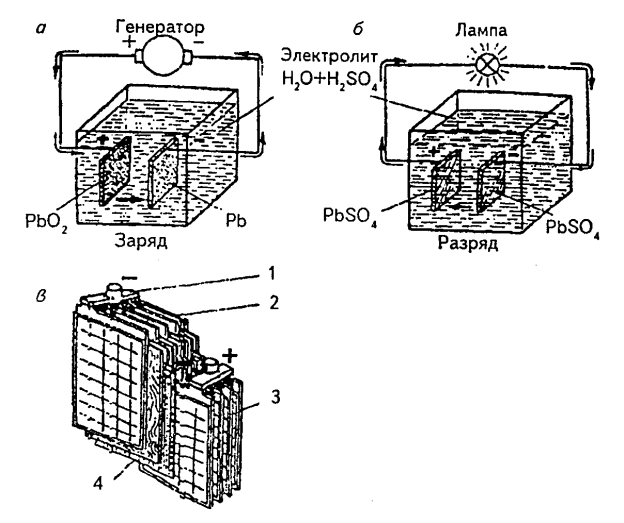
Рис. 2. Принцип действия аккумулятора: а − заряд; б − разряд; в − полублоки отрицательных и положительных пластин; 1 − баретка полублока отрицательных пластин; 2 − отрицательные пластины; 3 − положительные пластины; 4 − сепараторы
При подключении аккумулятора к зарядному устройству электроны движутся к отрицательному электроду, нейтрализуя двухвалентные ионы свинца Рb2+. На электроде выделяется губчатый свинец Рb. Отдавая под влиянием напряжения внешнего источника тока по два электрона, двухвалентные ионы свинца Рb2+ у положительного электрода окисляются в четырехвалентные ионы Рb4+. Через промежуточные реакции ионы Рb4+ соединяются с двумя ионами кислорода и образуют двуокись свинца РbО2.
Химические реакции в свинцовом аккумуляторе описываются уравнением:
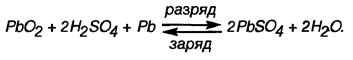
Содержание в электролите серной кислоты и плотность электролита уменьшаются при разряде и увеличиваются при заряде. По плотности электролита судят о степени разряженности свинцового аккумулятора:
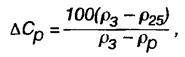
где Δ Ср - степень разряженности аккумулятора, %;
р3и рр - плотность электролита соответственно полностью заряженного и полностью разряженного аккумулятора при температуре 25°С, г/см2;
р25- измеренная плотность электролита, приведенная к температуре 25°С, г/см3.