
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Нарушение депонирования жиров
|
|
Нарушение нейроэндокринной регуляции жирового обмена. Масса тела человека находится под сложным контролем нервногуморальных влияний, определяющих пищевую мотивацию и уровень основного обмена. Центры регуляции пищевого поведения и основного обмена находятся в супраоптических ядрах гипоталамуса и контролируются таламусом, лимбической системой и корой. Центр голода локализован в вентролатеральных, а центр насыщения - в вентромедиальных ядрах подбугорья (связан с центром голода синапсами, передающими тормозные импульсы). Нейроны центра голода вырабатывают нейропептид Y, который активирует кортико-лимбические структуры мозга и стимулирует чувство голода, побуждая к поиску пищи. Эмоционально-поведенческие аспекты приема пищи регулируются отделами, расположенными
в кортикальной части лимбической системы (поясная извилина, гиппокамп, инфраорбитальная область) и в миндалине, разрушение которой вызывает безразличие к характеру предлагаемой пищи.
Подавление центра голода (при патологии вплоть до анорексии) обусловлено действием лептина1 (тормозит синтез нейропептида Y в центре голода и стимулирует образование в центре насыщения глюкагоноподобного пептида (ГПП) I, подавляющего аппетит; рис. 12-33); соматостатина, нейротензина, кортико- и тиреолиберина, меланокортинов гипофиза2; серотонина, вазопрессина, окситоцина; холецистокинина (сигналом для его выработки служит механическое растяжение) и других кишечных гормонов энтериновой системы (глюкагон, секретин, вазоактивный интестинальный пептид, гастрин, энтерогастрон); норадреналина, кальцитонина, инсулина; TNF-α (фактор некроза опухолей, или кахексин), выделяемого висцеральными адипоцитами в «сытом» состоянии. Перечисленные гормоны и нейротрансмиттеры связываются с рецепторами нейронов центра голода, снижают образование нейропептида Y и подавляют аппетит.
Активация центра голода и возникновение гиперрексии (булимии) может быть опосредовано нейропептидом Y (понижает симпатический и повышает парасимпатический тонус, а также угнетает половую функцию), эндорфинами и энкефалинами, соматолибери-
1 Лептин - основной гормон, контролирующий массу жировой ткани (обнаружен в 1994 г.). Механизмы действия лептина: усиление основного обмена, термогенеза и расхода энергии; стимуляция симпатического отдела ЦНС; повышение печеночного гликогенолиза и захвата глюкозы скелетными мышцами; активация липолиза в белой жировой ткани; усиление окисления жирных кислот в митохондриях гепатоцитов и скелетных мышц; подавление активности половых желез и репродуктивной функции; повышение продукции глюкокортикоидов. Лептин секретируется в основном адипоцитами белой жировой ткани. В норме его содержание в крови четко коррелирует с массой тела. Рецепторы к лептину обнаружены практически во всех клетках, но основной орган-мишень лептина - центральная нервная система. Действуя через специфические рецепторы гипоталамуса, лептин снижает аппетит (участвует в развитии кахексии, нервной анорексии и др.) и уменьшает запасы жира в жировых депо. Лептин является провоспалительным гормоном, способствующим преобладанию клеточного иммунитета, вследствие усиления продукции цитокинов ТЫ-типа. Лептин вырабатывается также остеобластами и тормозит образование остеокластов. Ген ожирения LEP (obese gene - ob) локализован на хромосоме 7q31.3, ген рецептора лептина - на хромосоме 1. Рецептор лептина человека имеет гомологичный участок с рецепторами интерлейкина (IL) 6 и других цитокинов.
2 Гипоталамическая система меланокортина и меланокортиновый рецептор MC-4R участвуют в передаче эффектов лептина.
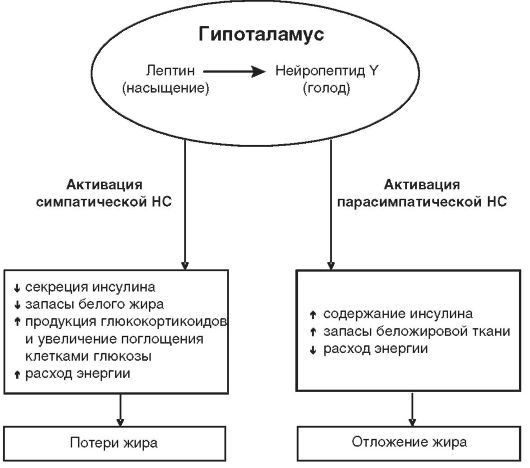 Рис. 12-33. Взаимосвязь между центральной нервной системой и лептином
Рис. 12-33. Взаимосвязь между центральной нервной системой и лептином
ном, дофамином, γ -аминомасляной кислотой (ГАМК), избытком инсулина.
Усиление липолиза имеет место при активации симпатоадреналовой системы (максимальный эффект через β,, -адренорецепторы, в буром жире адренергические терминали особенно обильны и образуют синапсы на самих адипоцитах, способствуя «залповому» липолизу); действии глюкагона (см. раздел 12.4.5), катехоламинов (высокие дозы стимулируют липолиз через β,, -адренорецепторы на адипоцитах, низкая концентрация адреналина действует через а2-рецепторы и увеличивает липогенез), тиреотропного гормона (ТТГ), тироксина, соматотропного гормона (СТГ), андрогенов, АКТГ (прямое действие на адипоциты), глюкокортикоидов (в физиологических концентрациях повышают использование жирных кислот в энергетическом обмене во всех тканях, кроме печени), TNF-α (снижает ответ мышечной и жировой ткани на инсулин и тормозит липогенез).
Усиление липогенеза может быть обусловлено парасимпатической импульсацией (парасимпатическая нервная система практически не иннервирует жировую ткань и потому не оказывает выраженного эффекта на ее метаболизм, однако вагусная импульсация уменьшает выделение норадреналина из пресинаптических окончаний, что косвенно может опосредовать преобладание липогенеза); действием инсулина (см. раздел 12.4), глюкокортикоидов (в высоких дозах усиливают липолиз в конечностях и липогенез в области лица и туловища; их эффект зависит от действия катехоламинов и различен в адипоцитах разной локализации, поскольку набор адренорецепторов на жировых клетках неодинаков и зависит от их анатомического расположения), АКТГ (см. раздел 12.4), пролактина и эстрогенов (через гиперинсулинемию; кроме того, пролактин стимулирует синтез фосфолипидов и ТАГ в молочных железах и других тканях).
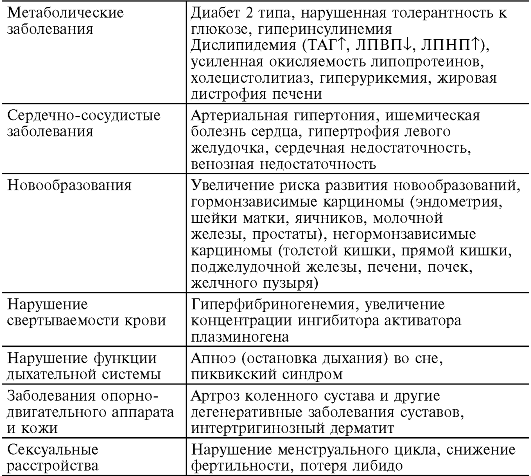
Ожирение - избыточное отложение жира в жировой ткани. Ожирение значительно повышает риск развития артериальной гипертонии, сахарного диабета 2 типа, атеросклероза, поэтому очень важно следить за своим весом. Считается, что человек страдает ожирением, если его масса превышает нормальную более чем на 20% и продолжает увеличиваться далее. Этим недугом страдает более трети взрослого населения России. В 1998 г. Всемирная организация здравоохранения (ВОЗ) признала ожирение хроническим заболеванием. По статистике ВОЗ, в экономически развитых странах около 30% взрослых и до 10% детей имеют ту или иную форму и степень ожирения. В возрастных группах после 50 лет это заболевание встречается чаще. За последнее десятилетие число таких больных в мире увеличилось почти в два раза и по оценке специалистов в 2025 г. их количество составит 300 млн человек. Ситуация тем более сложная, что с каждым годом увеличивается число молодых людей, страдающих ожирением, снижается общая продолжительность жизни населения земного шара в связи с тяжелыми заболеваниями, сопутствующими ожирению (см. табл. 12-5).
У тучных людей старше 50 лет смертность увеличивается на 50% по сравнению с лицами, не имеющими ожирения. У женщин с ожирением чаще встречаются рак эндометрия, яичника, шейки матки, желчного пузыря и молочной железы, у мужчин - рак предстательной железы и толстой кишки, снижение потенции. Жировая ткань, составляющая в норме 15-20% от массы тела у мужчин и 20-29% у женщин, - это метаболически активное образование.
Таблица 12-5. Заболевания, сопутствующие ожирению (по С. Бутровой,
2001;
 Адипоциты секретируют гемопоэтины; выделяют цитокины - TNF-α, IL-6, трансформирующий фактор роста (TGF) β и соответствующие им растворимые рецепторы; синтезируют биоактивные вещества - ангиотензиноген, ингибитор активатора плазминогена; ряд ферментов (липопротеиновая липаза, индуцируемая NO-синтаза, аполипопротеин Е) и гормонов (лептин, резистин, адипонектин, эстрогены); выделяют свободные жирные кислоты. Увеличение массы жировой ткани влечет за собой повышение содержания лептина в крови, причем его продукция в подкожной жировой клетчатке выше, чем в висцеральных жировых депо. Уровень лептина отражает не только количество накопленного жира, но и нарушения энергетического обмена: при голодании он значи-
Адипоциты секретируют гемопоэтины; выделяют цитокины - TNF-α, IL-6, трансформирующий фактор роста (TGF) β и соответствующие им растворимые рецепторы; синтезируют биоактивные вещества - ангиотензиноген, ингибитор активатора плазминогена; ряд ферментов (липопротеиновая липаза, индуцируемая NO-синтаза, аполипопротеин Е) и гормонов (лептин, резистин, адипонектин, эстрогены); выделяют свободные жирные кислоты. Увеличение массы жировой ткани влечет за собой повышение содержания лептина в крови, причем его продукция в подкожной жировой клетчатке выше, чем в висцеральных жировых депо. Уровень лептина отражает не только количество накопленного жира, но и нарушения энергетического обмена: при голодании он значи-
тельно снижается, при переедании - повышается. Избыток лептина вызывает инсулинорезистентность скелетных мышц и жировой ткани и подавляет действие инсулина на клетки печени (инсулин активирует адипоциты, повышая образование лептина, в свою очередь, лептин, воздействуя на собственные рецепторы, локализованные на поверхности β -клеток, тормозит секрецию инсулина).
У женщин наличие достаточно выраженной жировой ткани существенно для поддержания нормальной половой функции. Менструации у девочек, не достигших критической массы (около 48 кг), не начинаются, даже если пубертатный период пройден. При похудении на 10-15% нормы даже при сохранении цикла нет овуляции, возможна и полная аменорея. Эти изменения обратимы, при нормализации веса детородная функция восстанавливается. Вероятно, невозможность деторождения у женщин, не имеющих достаточных жировых запасов для успешного рождения и вскармливания ребенка, была выработана в процессе естественного отбора. У мужчин похудение и физические нагрузки приводят к уменьшению полового влечения, а если вес тела на 25% ниже нормы, выработка спермы угнетается. Следует отметить, что сильное развитие мускулатуры (например, у культуристов) действует на репродуктивные процессы так же, как и похудение. Избыток эстрогенов у полных мужчин приводит к снижению потенции, гинекомастии, гипогонадизму с понижением уровня тестостерона.
Классификация ожирения. Ожирение может возникать как самостоятельное заболевание - в этом случае говорят о первичном ожирении. Вторичное ожирение - это синдром, возникающий вследствие гормональных или других расстройств в организме.
Первичное ожирение возникает при нарушении гормональной связи между жировой тканью и гипоталамусом. Это генетически опосредованное нейроэндокринное заболевание, его главная черта - абсолютная или относительная лептиновая недостаточность. Около 20% больных имеют абсолютную лептиновую недостаточность, однако дефицит лептина1 не является основной причиной развития ожирения. Более 80% пациентов с первичным ожирени-
1 Генетически опосредованный дефицит лептина проявляется ранним ожирением, пониженным обменом веществ, гипогонадотропным гипогонадизмом, гиперинсулинемией, нарушением гипоталамо-питуитарных и тиреоидальных взаимодействий и нарушением количества и функции Т-лимфоцитов, что повышает восприимчивость больных к инфекциям. Известны 5 отдельных мутаций в гене лептина, вызывающих развитие первичного ожирения.
ем имеют выраженную гиперлептинемию, что свидетельствует о резистентности к гормону. Известны следующие механизмы резистентности:
• нарушение транспорта лептина через гематоэнцефалический барьер (введение гормона даже в больших дозах не дает результата);
• нарушение переноса гормона транспортными белками;
• мутации рецептора лептина1 (несмотря на продукцию лептина, центр голода продолжает секрецию нейропептида Y);
• мутации генов, кодирующих рецепторы к меланокортину2 (4% всех больных с ожирением). Следует отметить, что на фоне введения лептина у млекопитающих снижается только масса жировой ткани, в то время как при голодании снижается также масса других тканей.
Вторичное ожирение - синдром, возникающий при нарушении соотношения между процессами липолиза и липогенеза, носит симптоматический характер и порождается различными расстройствами (эндокринопатии, опухоли мозга, нарушения мозгового кровообращения и пр.).
По степени увеличения массы тела различают ожирение I степени (масса тела увеличена на 30%); II степени (на 30-50%); III степени (более чем на 50%).
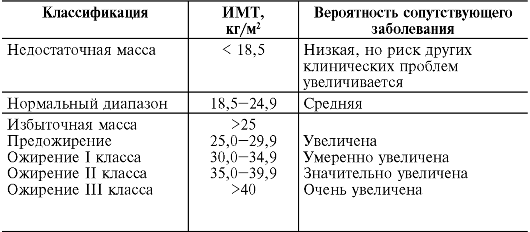
Одним из наиболее распространенных показателей для оценки степени ожирения является индекс массы тела (ИМТ), рассчитываемый следующим образом:
ИМТ= Вес (кг) / [Рост (м)]2.
Больные с ИМТ 30 кг/м2 и более, а также пациенты с ИМТ 27 кг/м2 или более, ожирение которых связано с такими факторами риска, как диабет 2 типа или дислипопротеинемия, подлежат обязательному лечению (табл. 12-6).
1 Дети с дефектом рецептора лептина быстро набирают избыточную массу в течение первых месяцев жизни, отличаются гиперфагией и агрессивным поведением во время еды. Иногда дефект рецептора имеет более выраженные проявления (гипотиреоз), чем отсутствие лиганда.
2 Меланокортины (адренокортикотропный и меланоцитостимулирующий гормоны, а также и их фрагменты) образуются в гипофизе из проопиомеланокортина. Лептин стимулирует экспрессию гена проопиомеланокортина, образующийся проопиомеланокортин расщепляется до субстрата, который действует как супрессор пищевого поведения, возможно через MC4R. При снижении гипоталамического меланокортинэргетического сигнала через рецепторы MC4R наблюдаются гиперфагия и прибавка массы.
Таблица 12-6. Классификация избыточной массы у взрослых в зависимости от индекса массы тела (в соответствии с докладом ВОЗ 1998 г.)
 Наиболее простым методом определения склонности к ожирению является измерение окружности талии. В идеале окружность талии не должна превышать 94 см у мужчин и 80 см у женщин. Если окружность талии у мужчин достигает 102 см, а у женщин - 88 см, возникает серьезная угроза увеличения риска заболевания.
Наиболее простым методом определения склонности к ожирению является измерение окружности талии. В идеале окружность талии не должна превышать 94 см у мужчин и 80 см у женщин. Если окружность талии у мужчин достигает 102 см, а у женщин - 88 см, возникает серьезная угроза увеличения риска заболевания.
По особенностям морфологии жировой ткани выделяют гипертрофическое и гиперпластическое ожирение.
Гипертрофическое ожирение связано с увеличением размеров адипоцитов (это лабильный фактор, зависимый от питания), чаще встречается в зрелом возрасте. При этом виде ожирения масса тела может увеличиваться в 3-3, 3 раза.
Гиперпластическое ожирение сопровождается увеличением количества адипоцитов. Начинается, как правило, в детском возрасте, так как дифференцировка фибробластических клеток-предшественниц в новые адипоциты во взрослом организме - явление довольно редкое (это происходит в период внутриутробного развития и в раннем грудном возрасте). В развитии гиперпластического ожирения огромное значение имеет наследственность, определяющая пролиферативные возможности этих клеток. Избыток массы тела при гиперпластическом ожирении может достигать гигантских величин (до 1000%). Следует отметить, что в подростковый и предклимактерический периоды повышается пролиферативная активность преадипоцитов. Кроме того, их деление индуцируют избыточная калорийность пищи, сахарный диабет или переедание у беременных. В этих случаях гиперпластическое ожирение развивается у взрослых.
Жир может располагаться в подкожно-жировой клетчатке (подкожный жир) и вокруг внутренних органов (висцеральный жир), вместе подкожно-жировая клетчатка в области живота и висцеральный жир брюшной полости составляют абдоминальный жир. Разная локализация жировых отложений при различных формах первичного и вторичного ожирения зависит от влияния мужских и женских половых гормонов на распределение и катехоламиновых рецепторов в разных отсеках жировой ткани. Жировая ткань, локализованная в различных частях тела, отличается по своей гормональной функции (см. раздел 12.4). У людей, склонных к первичному ожирению, уменьшена экспрессия β -адренорецепторов на адипоцитах.
В зависимости от характера распределения жировой ткани различают:
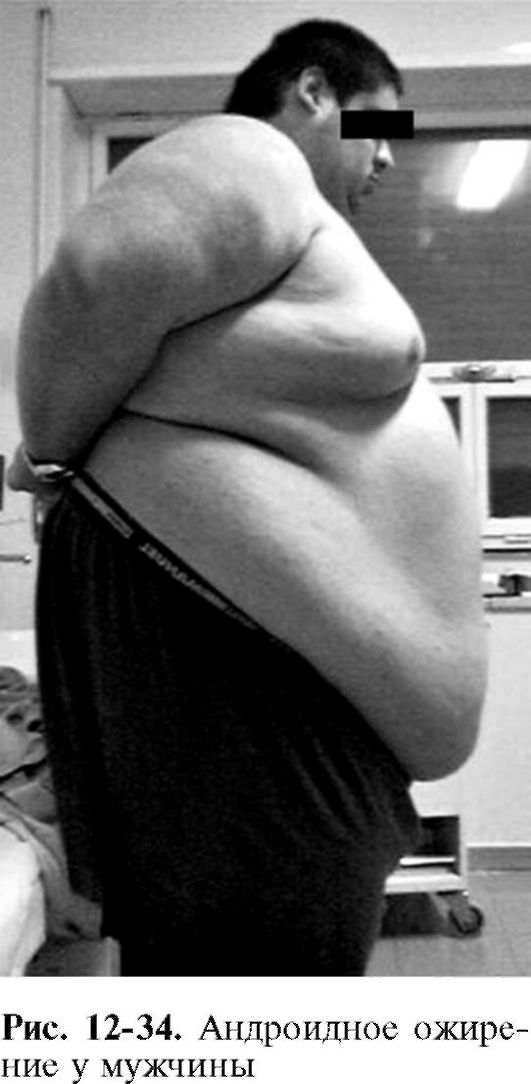
• андроидный (яблочный) тип
ожирения, когда избыточные отложения жира располагаются на животе и верхней части туловища (наиболее характерен для мужчин) (рис. 12-34);
• гиноидный (грушевидный) тип ожирения, когда избыточные отложения жира располагаются на бедрах, ягодицах и в нижней части туловища (наиболее характерен для женщин);
• смешанный тип ожирения - комбинирует признаки андроидного и гиноидного типов.
Гиноидное ожирение чаще носит гиперпластический характер, поэтому оно более резистентно к диетотерапии. Однако более патогенным считается андроидное, а более благоприятными - гиноидное, смешанное.
Отложение жировой клетчатки в абдоминальной области (яблочный или верхний тип ожирения) больше связано с заболеваемо-
 стью и смертностью, чем гиноидный или нижний тип ожирения, и даже больше, чем степень ожирения. Большое количество абдоминального жира способствует развитию дислипидемии, сахарного диабета, сердечно-сосудистых заболеваний, у женщин - возникновению саркомы. Эта зависимость не связана с общим содержанием жира в организме. При одинаковом ИМТ абдоминальное ожирение имеет более высокий риск развития сопутствующих заболеваний, чем ожирение по нижнему типу, что увеличивает смертность у людей.
стью и смертностью, чем гиноидный или нижний тип ожирения, и даже больше, чем степень ожирения. Большое количество абдоминального жира способствует развитию дислипидемии, сахарного диабета, сердечно-сосудистых заболеваний, у женщин - возникновению саркомы. Эта зависимость не связана с общим содержанием жира в организме. При одинаковом ИМТ абдоминальное ожирение имеет более высокий риск развития сопутствующих заболеваний, чем ожирение по нижнему типу, что увеличивает смертность у людей.
По этиологии ожирение классифицируют на экзогенно-конституциональное, гипоталамическое, гормональное (эндокринное).
Экзогенно-конституциональное ожирение (часто, но не всегда относится к первичной форме ожирения). Нарушение пищевого поведения (например, синдром ночной еды, повышенное потребление пищи в ответ на стресс) приводит к отложению избытка жира в организме в соответствии с формулой:
Отложение жира = Поступление энергии - Расход энергии.
Длительное повышение активности «пищевого центра» ведет к повышению аппетита (гиперфагии) и ожирению (рис. 12-35). Привычка переедать может быть приобретена в детстве. Так, установлено, что избыточное кормление ребенка первого года жизни
 Рис. 12-35. Ожирение в связи с гиперфагией и перееданием. Матиас Галлас - полководец Тридцатилетней войны (1618-1648). Гравюра неизвестного художника XVII в. (из фонда кафедры патофизиологии
Рис. 12-35. Ожирение в связи с гиперфагией и перееданием. Матиас Галлас - полководец Тридцатилетней войны (1618-1648). Гравюра неизвестного художника XVII в. (из фонда кафедры патофизиологии
СибГМУ)
способствует развитию гиперпластического ожирения, характеризующегося увеличением объема жировых клеток.
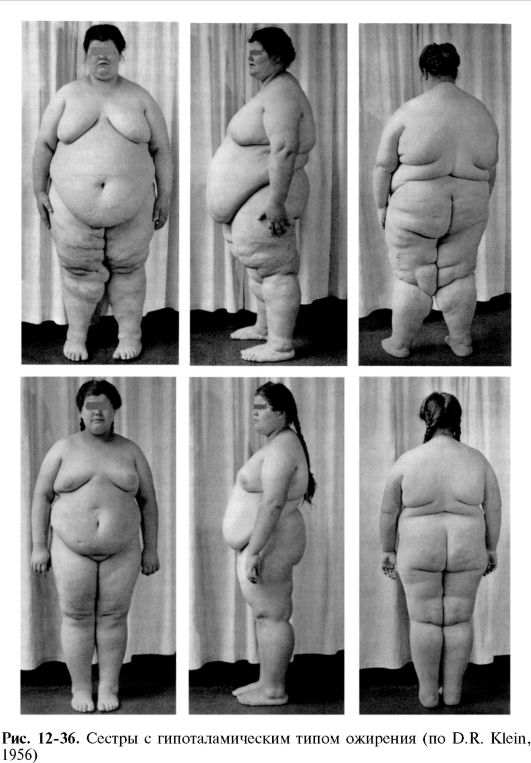
Гипоталамическое ожирение. Является следствием поражения области гипоталамуса. Причиной могут быть перенесенные травмы головного мозга, стойкая внутричерепная гипертензия, опухоли мозга, менингит, а также врожденные дегенеративные изменения гипоталамической области (например, синдром Фрелиха) (рис. 12-36).
Гормональное ожирение. Связано как с гипо-, так и с гиперфункцией желез внутренней секреции и развивается при гипотиреозе, гипофункции половых желез, а также при гиперинсулинизме и гиперкортицизме. В крови таких больных повышается содержание ЛПНП и ЛПОНП, НЭЖК. При гормональном ожирении рано развивается гипертриацилглицеролемия и несколько позже - гиперхолестеринемия. Нарушению обмена липидов сопутствует изменение углеводного обмена: развивается гипергликемия, стимулирующая секрецию инсулина и его предшественника. В свою очередь, секрецию проинсулина и инсулина стимулируют НЭЖК, ЛПОНП, ЛПНП. Усиленный выброс глюкокортикоидов, стимулирующих глюконеогенез, также повышает уровень инсулина в крови.
По патогенезу различают алиментарное, метаболическое и энергетическое ожирение.
Алиментарное ожирение - развивается при чрезмерном потреблении пищи, что может быть обусловлено:
а) нарушением деятельности гипоталамического пищевого центра (абсолютная или относительная лептиновая недостаточность, длительное возбуждение вентролатеральных ядер в результате травм, кровоизлияний, воспаления в диэнцефальной области (по этиологии это экзогенно-конституциональное или гипоталамическое ожирение);
б) афферентной импульсацией при частом возбуждении вкусовых рецепторов;
в) переходом от активного к малоподвижному образу жизни. При этом в некоторых случаях сохраняется высокий уровень возбудимости пищевого центра (характерный для лиц физического труда или спортсменов), что приводит к систематическому перееданию;
г) чрезмерным растяжением стенок желудка при его переполнении. Это снижает чувствительность нервных окончаний слизи-
 стой оболочки, и тормозящие импульсы передаются в пищевой центр только при очень большом скоплении пищи в желудке. В результате переедание становится постоянным и возникает ожирение;
стой оболочки, и тормозящие импульсы передаются в пищевой центр только при очень большом скоплении пищи в желудке. В результате переедание становится постоянным и возникает ожирение;
д) пожилым возрастом, что объясняется несоответствием между прежним уровнем возбудимости центра голода и меньшими энергозатратами (после 25 лет основной обмен снижается в каждые последующие 10 лет примерно на 7, 5%). Интересно отметить, что в глубокой старости часто развивается исхудание, поскольку угнетается активность пищевого центра и снижается переход углеводов в жиры.
Метаболическое ожирение обусловлено повышенным синтезом жира из углеводов. В обычных условиях до 30% поступающей в организм глюкозы под действием инсулина превращается в жир. При гиперфункции инсулярного аппарата этот процент возрастает. Аналогичное изменение метаболизма развивается при повышенной продукции пролактина (гормона передней доли гипофиза), глюкокортикоидов (по этиологии это гормональное ожирение).
Энергетическое ожирение обусловлено недостаточным использованием жиров в качестве источника энергии. Развивается при гиподинамии в сочетании с хорошим аппетитом, при снижении тонуса симпатической нервной системы и недостаточной продукции жиромобилизующих гормонов (СТГ, тиреоидные гормоны, катехоламины), поскольку задерживается выход жира из депо и использование его в качестве энергетического субстрата (по этиологии соответствует экзогенно-конституциональному или гормональному ожирению).
Последствия ожирения. При ожирении постепенно изменяется белковый обмен, который характеризуется снижением уровня общего белка крови преимущественно за счет уменьшения концентрации альбуминов, увеличением содержания фибриногена, продуктов деградации фибрина, снижением уровня гепарина. Следствием этого является нарушение транспорта НЭЖК и других липидов, снижение фибринолитической активности и повышение тромбогенных свойств крови, возникновение тромбоэмболических осложнений. Эти изменения являются факторами риска атеросклероза, ишемической болезни сердца, инсульта, гипертонической болезни. Возникают нарушения функций ЦНС: отмечаются утомляемость, сонливость, ухудшение памяти; развивается преждевременное старение, возникают изменения во внутренних
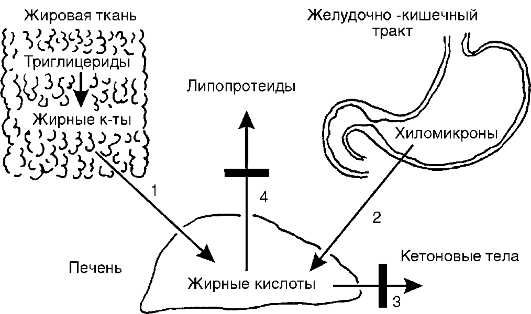 Рис. 12-37. Причины жировой инфильтрации печени: 1 - усиленный выход неэтерифицированных жирных кислот из жировой ткани; 2 - интенсивное длительное поступление хиломикронов из кишечника в кровь, а затем в печень; 3 - задержка окисления жирных кислот в печени до кетоновых тел; 4 - задержка выхода из печени пре-β - и β -липопротеинов. Затемненные прямоугольники - места нарушения процесса
Рис. 12-37. Причины жировой инфильтрации печени: 1 - усиленный выход неэтерифицированных жирных кислот из жировой ткани; 2 - интенсивное длительное поступление хиломикронов из кишечника в кровь, а затем в печень; 3 - задержка окисления жирных кислот в печени до кетоновых тел; 4 - задержка выхода из печени пре-β - и β -липопротеинов. Затемненные прямоугольники - места нарушения процесса
органах, например жировая инфильтрация (ожирение или жировая трансформация) печени (рис. 12-37).
При первичном ожирении многие из расстройств метаболизма после нормализации веса корректируются (уменьшается или совсем проходит инсулинорезистентность, гипер- и дислипопротеинемия). Тем не менее у больного сохраняется лептиновая недостаточность, повышена активность липопротеиновой липазы жировой ткани, снижена реакция центров насыщения на серотонин, а адипоцитов - на β -адреномиметики, нарушена рецепция инсулина в гипоталамусе, а при гиперпластическом и смешанном ожирении увеличено число адипоцитов и т.д.
При быстрой нормализации веса снижается продукция тиреотропина, ухудшается холодовая адаптация. При дальнейшем падении массы тела еще больше снижается основной обмен. Отмечается тенденция к лейкопении, брадикардии и гипотонии, снижается иммунитет. У женщин возможно нарушение овариально-менструального цикла, которое связано со снижением эстрогенпродуцирующей функции адипоцитов. Многие похудевшие пациенты испытывают дисфорию, отмечаются обсессивные неврозы в связи с понижением выработки опиатных пептидов. Не-
которые психосоматические особенности похудевших пациентов с первичным ожирением напоминают таковые при психогенной анорексии. При голодании, диетах отмечается недостаток выделения серотонина, норадреналина, β -эндорфина и других биологически активных веществ в кровь. Снижение уровня серотонина субъективно воспринимается организмом человека как состояние депрессии, уменьшение концентрации норадреналина - упадка сил, β -эндорфина - неудовольствия, дискомфорта. Напротив, выделение норадреналина после еды вызывает чувство прилива сил, энергии, увеличивает уровень основного обмена. У людей с нарушениями центральной серотонинергической системы особенно сильны негативные реакции на голод, выражающиеся в снижении продукции серотонина. Даже при незначительном голодании у них развивается выраженная депрессия.
Адекватное лечение больного ожирением возможно лишь под наблюдением врача и не должно быть только симптоматическим, т. е. сводиться к диетотерапии и лечебной гимнастике. После открытия лептина большие надежды связывали с его применением для лечения лептиновой недостаточности при первичном ожирении.