
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Екзаменаційний білет № 8 1. Стабільні ізотопи в геохімії.
|
|
Якщо нукліди належать одному й тому самому хімічному елементу і мають однакову кількість протонів, але різняться за кількістю нейтронів, то вони називаються ізотопними нуклідами, або просто ізотопами (від гр. ізос — однаковий і топос — місце) Ізотопи — це нукліди одного хімічного елемента, які мають однакове протонне число (заряд ядра). Позначення нуклідів Оксигену: Оксиген-16, Оксиген-17, Оксиген-18 або 16О, 17О, 18О
Ізотопи (окремі нукліди) поділяють на стабільні і радіоактивні (радіонукліди). Стабільні нукліди мають усі «парні» елементи і більшість «непарних» з протонним числом (зарядом ядра) < 83. Нукліди всіх елементів, розміщених у періодичній системі після Вісмуту, радіоактивні.
1.Стабільними є головним чином ті нукліди(ізотопи), у яких N і Z(протони і нейтрони) приблизно рівні. До Са в ядрах N = Z, ці атоми очевидно стабільні. 2. Велика частина стабільних нуклідів має парні Z і N. 3. Менш поширені стабільні нукліди з парним Z і непарним N або парних N і непарних Z. 4. Дуже рідкісні стабільні нукліди з непарними Z і N.
Стабільні ізотопи легких елементів (A< 40) характеризуються найбільшою відносною різницею мас,
що й забезпечує їх інтенсивне фракціонування в геохімічних процесах. Типові приклади − ізотопи H, C, O, S, особливо першого з них. Вони й використовуються найбільш широко в геохімії стабільних ізотопів:




14C – період напіврозпаду = 5730 р., Найбільш розповсюджені 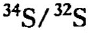
інші (10, 11) – “вимерлі”
Геохімія стабільних ізотопів використовується для вирішення різних проблем, наприклад, в геотермометрах для визначення температури утворення порід і мінералів, в магматичних породах для вирішення питання - чи була контамінація корови матеріалом, так як кора має різні ізотопні відносини кисню, ніж мантія.Числові значення ізотопних відносин (2Н/1Н, 18О / 16о, 13С/12С) в різних хімічнихсполуках атмосфери, гідросфери, породах і мінералах літосфери можутьрозглядатися як числові характеристики геологічних об'єктів (газів, води, мінералів, порід), що відображають умови їх походження (генезису).
Загальні принципи: Фракціонування – перш за все за рахунок того, що рух молекул, тобто енергія речовини, залежить від маси їх атомів. Різниця мас атомів впливає на (1)коливальну, (2)поступову та (3)обертальну компоненти руху молекул. Це й призводить до розділення ізотопів.
Наприклад, (2) та (3) не є характерними для твердих тіл. Тому фракціонування ізотопів в мінералах контролюється лише (1).
Зовнішні фактори: (а) – реакції ізотопного обміну, (б) – фізико-хімічні процеси (випаровування/конденсація, плавлення/кристалізація, дифузія)
Представлення ізотопного віку: (параметр порівняння стабільних ізотопів) δ = 1000(R – Rstand)/Rstand (Δ)
R – відношення ізотопів елемента узразку (більш важкий ізотоп – у чисельнику)
Rstand – таке ж відношення в стандарті
Одиниці виміру – проміле (‰), або тисячні частки. Сучасна точність виміру до + 0, 0n ‰
Для фаз A та B: Δ (A-B) = δ (A) – δ (B) (різниця ізотопних відношен)
α (A-B) = R(A)/R(B) або α (A-B) = [1000+ δ (A)]/[1000+δ (B)] (константа фракціонування або фактор фракціонування)
δ = 1000(R – Rstand)/Rstand, де R – відношення ізотопів елемента узразку (більш важкий ізотоп – у чисельнику), Rstand – таке ж відношення в стандарті. Одиниці виміру – проміле (‰), або тисячні частки. Для фаз A та B: Δ (A-B) = δ (A) – δ (B) (різниця ізотопних відношен)
α (A-B) = R(A)/R(B) або α (A-B) = [1000+ δ (A)]/[1000+δ (B)] (константа або фактор фракціонування)
Стабільні ізотопи: температурна залежність (300-12000С)
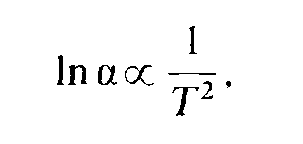
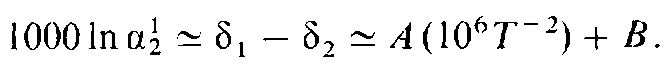
Стандарти: 18O/16O та 2D/1H – SMOW: Стандартна середня океанічна вода
13C/12C – PDB: Карбонат белемнита з крейдяної формації Піді (США)
34S/32S – CD: Троіліт з метеорита К-Д’ябло