
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Зародження та швидкість росту кристалів в природних системах як кінетичний фактор. Його вплив на коефіцієнти розподілу хімічних елементів.
|
|
Кристалізація — процес утворення кристалів з пари, розчинів або розплавів та з речовини в іншому кристалічному або аморфному стані. Кристалізація починається при досягненні деяких граничних умов, наприклад, переохолодженні рідини або перенасиченні пари, коли практично миттєво виникає багато дрібних кристаликів — центрів кристалізації. Кристалики ростуть, приєднуючи атоми з рідини або пари. Ріст граней кристалу відбувається пошарово, краї незавершених атомних шарів (сходинки) при рості рухаються вздовж граней. Залежність швидкості росту від умов кристалізації приводить до різноманітності форм росту та структури кристалів (багатогранні, пластинчасті, голчасті, скелетні, дендритні та ін. форми, олівцеві структури і т. д.). В процесі кристалізації також виникають різні дефекти кристалічної ґратки.
Якщо насичений при високій температурі розчин твердої речовини охолодити, то з нього буде виділятися надлишок розчиненої речовини у вигляді кристалів, а в розчині залишатиметься така її кількість, яка утворює насичений розчин при нижчій температури, такий процес називається кристалізацією.
Процес кристалізації відбувається і при випарюванні розчину. При цьому внаслідок виділення певної кількості води ненасичений спочатку вихідний розчин стає насиченим, а потім і пересиченим, який легко розкладається, і надлишок розчиненої речовини виділяється у вигляді кристалів.
Від умов кристалізації залежить розмір утворюваних кристалів. Великі кристали утворюються при дуже повільному і спокійному охолодженні насиченого при високій температурі розчину або при дуже повільному і спокійному його випарюванні. При швидкому охолодженні і інтенсивному перемішуванні насиченого розчину або при швидкому його випарюванні виникають дрібні кристали. Чим швидше охолодження й інтенсивніше перемішування розчину, тим дрібніші кристали.
Мерой когерентности-некогерентности является коэффициент распределения Кр, равный отношению концентраций элемента в твердой и жидкой фазах.
Кр=Cs/Cl 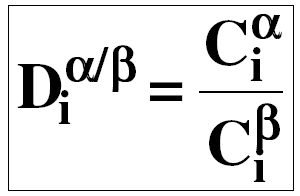
В условиях равновесия Кр является константой для данной системы. По определению несовместимые элементы имеют Kp< 1, а совместимые - Kp> 1. Коэффициент распределения зависит от состава минерала и расплава, Т и Р. Расплав как правило равновесен более чем с одной твердой фазой, поэтому используют валовые коэффициенты распределения расплав - твердое. Валовый или суммарный коэффициент распределения (D) равен сумме частных Кр с учетом доли каждого минерала в твердом, считая, что сумма долей равна 1. D= Σ Kd i*xi. Например, для гранатового перидотита: Способы определения Кр для минералов включают: 1. термодинамический расчет, 2. экспериментальные измерения, 3. определение концентраций во вкрапленниках и стекле или основной массе эффузивов.
2. Формування магматичних, пегматитових рудних родовищ в ході магматичної еволюції.
Ендогенні родовища (рос. эндогенные месторождения, англ. endogenous deposits; нім. endogene Lagerstä tten f pl) – гіпогенні родовища, магматогенні родовища, поклади корисних копалин, пов'язані з геохім. процесами глибинних частин Землі.
Формуються з магматичних розплавів або з газових і рідких гарячих мінералізованих розчинів серед глибинних геол. структур в умовах високого тиску і температури.
Серед Е.р. виділяють 5 гол. генетичних груп: магматичні, пегматитові, карбонатитові, скарнові, гідротермальні.
Кристалізація розплаву починаеться тоді коли солідус починае переважати над ліквідусом. Так утворюються магматичні родовища, тоді як пегматитові утворюються з розплаву який є пересичений на воду (замість звичайних 3%-10%), і при різкому потраплянні у вільний простір для кристалізації.