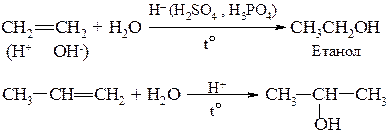Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
І. Реакції приєднання
|
|
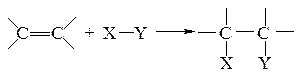
1. Приєднання водню (+Н2) – гідрування з утворенням алканів:
Pt
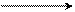 СН2=СН2 + Н2 CН3− СН3
СН2=СН2 + Н2 CН3− СН3
Етен або Ni, 150˚ С Етан
2. Приєднання галогенів (+ F2, Cl2, Br2, I2) – галогенування з утворенням дигалогеналканів:
Бромна вода (розчин Br2 у воді) має жовтий колір. При взаємодії з алкенами вона обезбарвлюється, тому реакція з бромною водою використовується для ідентифікації алкенів (якісна реакція на алкени).
3. Приєднання галогеноводнів (+НHal) – гідрогалогенування, утворюються моногалогеналкани:
СН2 = СН2 + НCl → CH3− CH2Cl
Етен Хлоретан
Приєднання галогеноводнів до несиметричних алкенів відбувається за правилом В.В. Марковнікова.
Правило Марковнікова. При приєднанні речовин типу НХ (Х = Hal, ОН і т.п.) до несиметричних алкенів атом водню приєднується до атома вуглецю з кратним зв’язком, зв’язаним з більшим числом атомів водню:
Наприклад:

Орієнтація приєднання пояснюється поляризацією молекули несиметричного алкена в результаті дії індуктивного ефекта алкільних груп:
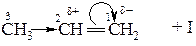
Метильна група відштовхує електрони σ –зв’язку СН3− С−, що призводить до поляризації π –зв’язку. Електрони π –зв’язку є дуже рухливими, тобто легко зміщуються до атому С (1). Це зміщення показують зігнутою стрілкою(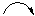 ). В результаті на атомі С (1) виникає частковий негативний заряд δ ‾, а на атомі С (2) частковий позитивний заряд δ +. При приєднанні галогеноводню протон Н+ приєднується до атома С (1), який несе частковий негативний заряд.
). В результаті на атомі С (1) виникає частковий негативний заряд δ ‾, а на атомі С (2) частковий позитивний заряд δ +. При приєднанні галогеноводню протон Н+ приєднується до атома С (1), який несе частковий негативний заряд.
При наявності в молекулах ненасичених вуглеводнів замісників, які проявляють значний електронно акцепторний ефект, реакція приєднання Н− Х іде проти правила Марковнікова: СН2=СН− Х (Х= CN, CF3, NO2, COOH)
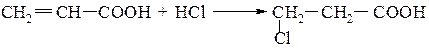
4. Приєднання води (+Н2О) – гідратація з утворенням насичених одноатомних спиртів (алканоли СnH2n+1OH)