
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Представляет собой отношение массы компонента, содержащегося в системе (растворе), к объему этой системы (раствора).
|
|
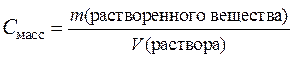
где m – масса растворенного вещества, V – объем раствора.
Наиболее часто используется массовая концентрация, имеющая размерности [ кг/м3 ], [ г/л ], [г/см3 ], [мг/л ].
Масса вещества в граммах, содержащегося в одном кубическом сантиметре, или одном миллилитре раствора, называется титром раствора.
Например, раствор с титром Т = 0, 05, содержит 0, 05 г растворенного вещества в 1 мл раствора.
· Молярная концентрация.
Представляет собой отношение количества растворенного вещества (в молях) к объему раствора (в литрах).
Значение молярной концентрации показывает число молей растворенного вещества, содержащихся в растворе объемом 1 литр. Молярная концентрация имеет размерность [моль/л] и обозначается СМ:
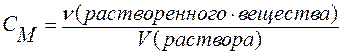
где ν – количество растворенного вещества (в молях); V – объем раствора (в литрах).
Например, раствор серной кислоты с молярной концентрацией СM(H2SO4) = 2 моль/л содержит в объеме, равном 1 литр, серную кислоту количеством вещества 2 моль.
· 6. Нормальная концентрация.
В настоящее время чаще употребляется термин «молярная концентрация эквивалента». Этот способ выражения количественного состава растворов представляет собой отношение количества эквивалентов растворенного вещества (в молях) к объему раствора (в литрах).
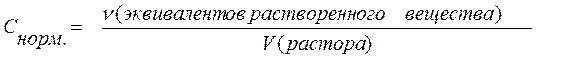
 Значение нормальной концентрации показывает количество эквивалентов растворенного вещества (в молях), которое содержится в 1 литре раствора.
Значение нормальной концентрации показывает количество эквивалентов растворенного вещества (в молях), которое содержится в 1 литре раствора.
Размерность нормальной концентрации [моль/л].
Например, раствор гидроксида бария с молярной концентрацией эквивалента С(1/2 ВаCl2) = 4 моль/л (нормальной концентрацией СH(ВаCl2) = 4 моль/л) содержит четыре моль эквивалентов ВаСl2 в растворе объемом 1 литр.