
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Десятый класс
|
|
Задача 10-1 (автор Куриленко К. А.)
1. На основании того, что соль A имеет интенсивно-синюю окраску и образуется из растворов солей железа и цианида калия, можно предположить, что она является цианидным комплексом железа – Fe4[Fe(CN)6]3 (берлинская лазурь). Эта краска в 18 веке широко использовалась в красильном деле и книгопечатании. Исходя из этого предположения, можно определить состав соли В, она может содержать ионы калия и анионы: [Fe(CN)6]3− или [Fe(CN)6]4−
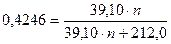 ;
;
где n – количество атомов калия в B,
решая уравнение, находим n = 4, откуда B – K4[Fe(CN)6].
A − Fe4[Fe(CN)6]3 или KFe[Fe(CN)6] (берлинская лазурь, железная лазурь, парижская лазурь, прусская лазурь, гамбургская синь);
B – K4[Fe(CN)6] (желтая кровяная соль, желтое синькали).
2. При прокаливании железа с серой образуется сульфид железа,
Fe + S → FeS (реакция 1)
который взаимодействует с цианидом калия, образуя желтую кровяную соль;
6KCN + FeS → K4[Fe(CN)6] + K2S (реакция 2);
если же к полученному после растворения в воде раствору K4[Fe(CN)6] добавить подкисленный раствор железного купороса на воздухе, то будет выделяться осадок берлинской лазури;
3K4[Fe(CN)6] + 12FeSO4 + 3O2 +6H2SO4 → Fe4[Fe(CN)6]3 +4Fe2(SO4)3 +6K2SO4 + 6H2O
(реакция 3).
Fe4[Fe(CN)6]3 разлагается под действием щелочей с выделением гидратированного оксида железа Fe2O3∙ n H2O;
Fe4[Fe(CN)6]3 + 12KOH → 2Fe2O3∙ n H2O + 3K4[Fe(CN)6] + (6 – 2 n)H2O (реакция 4).
3. Метод получения берлинской лазури, описанный Д. Вудвордом, заключает в себе ряд недостатков, так при прокаливании органических остатков (кожа, шерсть) большое количество азота теряется в виде аммиака, синильной кислоты, летучих органических соединений, и лишь 10 – 15 % переходит в KCN, поэтому сейчас используют другие способы получения цианида калия.
а) 2CH4 + 3O2 + 2NH3 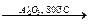 2HCN + 6H2O; HCN + KOH ® KCN + H2O.
2HCN + 6H2O; HCN + KOH ® KCN + H2O.
б) CaC2 + N2 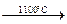 CaCN2 + C; CaCN2 + C + K2CO3
CaCN2 + C; CaCN2 + C + K2CO3 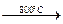 2KCN + CaCO3.
2KCN + CaCO3.
в) K2CO3 + 2NH3 + C 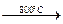 2KCN + 3H2O.
2KCN + 3H2O.
4. При взаимодействии желтой кровяной соли K4[Fe(CN)6] с хлором протекает окислительно-восстановительная реакция, в которой железо изменяет степень окисления с +2 на +3. В результате этого образуется другая комплексная соль калия – K3[Fe(CN)6] (соль С).
Исходя из данных, можно посчитать состав соли D;
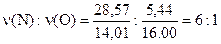 ;
;
по этому соотношению можно судить, что в соли D содержится один атом кислорода. Тогда
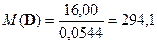 ;
;
Учитывая то, что цианокомплексы железа довольно устойчивы, можно предположить, что D содержит, кроме кислорода и азота, еще атомы железа, углерода и калия. Из вышесказанного следует, что анион соли D содержит центральный атом железа, 5 координированных цианид-ионов и, возможно, нитрозогруппу NO+. Тогда получаем
M (катиона) = 294, 1 − 5∙ M (CN) – M (NO) − M (Fe) = 294, 1 − 5∙ 26, 02 – 30, 01 − 55, 85 = 78, 14
Эта молярная масса соответствует 2 атомам калия, значит соль D – K2[Fe(NO)(CN)5].
C − K3[Fe(CN)6] (красная кровяная соль, красное синькали);
D – K2[Fe(NO)(CN)5] (нитропруссид калия).
5. При окислении K4[Fe(CN)6] хлором образуется красная кровяная соль по уравнению
2K4[Fe(CN)6] + Cl2 → 2K3[Fe(CN)6] + 2KCl (реакция 5);
если же обрабатывать желтую кровяную соль концентрированной азотной кислотой, то образуется K2[Fe(NO)(CN)5]
5K4[Fe(CN)6] + 18HNO3 → 5K2[Fe(NO)(CN)5] + 4N2 + 5CO2 + 10KNO3 + 9H2O
(реакция 6).
Система оценивания:
1. Формулы солей А и В 2 балла ´ 2 = 4 балла;
Подтверждение расчетом соли B 0, 5 балла;
Названия А и В 1 балл ´ 2 = 2 балла;
2. Уравнения реакций 1–4 1 балл ´ 4 = 4 балла;
3. Способ получения KCN 1 балл;
4. Формулы солей С и D 2 балла ´ 2 = 4 балла;
Подтверждение расчетом соли D 0, 5 балла;
Названия C и D 1 балл ´ 2 = 2 балла;
5. Уравнения реакций 5–6 1 балл ´ 2 = 2 балла;
Итого 20 баллов.
Задача 10-2 (автор Ильин М. А.)
1-2. Анализ условия задачи позволяет предположить, что речь идет о соединениях серы: простым веществом Ж желтого цвета может быть сера (S), а отвратительно пахнущим ядовитым газом И с молярной массой 34 г/моль (плотность по аммиаку 2, 0, M = 17 · 2 = 34 г/моль) является сероводород (H2S).
Установим формулы солей Д и Е. Заметим, что сумма содержания натрия и серы для соли Е составляет 100 % (т. е. вещество Е – бинарное), а для соли Д до 100 % не хватает 38, 08 %, которые, вероятно, приходятся на кислород. Тогда:
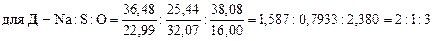
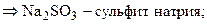
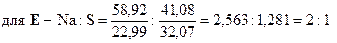
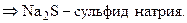
При кипячении раствора сульфита натрия с тонкорастертым порошком серы образуется А – тиосульфат натрия (мольное соотношение реагентов 1: 1):
Na2SO3 + S  Na2S2O3 (1)
Na2S2O3 (1)
При подкислении водного раствора тиосульфата натрия, вместо тиосерной кислоты (соединение В, H2S2O3) образуется сера и выделяется сернистый газ (З, SO2):
Na2S2O3 + 2HCl ® 2NaCl + H2O + S¯ + SO2 (3)
Нагревание раствора сульфида натрия с тонкорастертым порошком серы приводит к образованию полисульфидов Na2Sn. В зависимости от количества введенной в реакцию с сульфидом серы, удается получить полисульфиды с n = 2–6. Поскольку в условии задачи мольное соотношение сульфида натрия (в расчете на безводную соль) к сере составляет ~1: 3 (на ~0, 1 моль (~8 г) Na2S берут ~0, 3 моль (~10 г) S), соль Б – тетрасульфид натрия:
Na2S + 3S 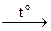 Na2S4. (2)
Na2S4. (2)
При добавлении к водному раствору тетрасульфида натрия избытка соляной кислоты на холоду (~ -10 °C) образуется тетрасульфан (Г) в виде маслянистой желто-оранжевой жидкости. Полисульфан быстро разлагается с образованием серы и сероводорода.
Na2S4 + 2HCl 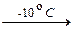 2NaCl + H2S4¯. (4)
2NaCl + H2S4¯. (4)
H2S4 ® 3S¯ + H2S (5)
3. Тиосульфат-ион проявляет восстановительные свойства. Слабые окислители, например, иод, окисляют его до тетратионат-иона (эту реакцию используют в иодометрическом титровании):
2Na2S2O3 + I2 ® Na2S4O6 + 2NaI.
Более сильными окислителями, такими, как хлор, тиосульфат-ион окисляется до сульфат-ионов:
Na2S2O3 + 4Cl2 + 5H2O ® 2NaHSO4 + 8HCl
или
Na2S2O3 + 4Cl2 + 5H2O ® Na2SO4 + H2SO4 + 8HCl.
4. 2FeCl3+ 3Na2S ® 6NaCl + 2FeS¯ + S¯ (6)
2FeCl3 + 3Na2S4 ® 6NaCl + 2FeS2¯ + 8S¯ (7)
SbCl3 + 3Na2Sизб. ® Na3[SbS3] + 3NaCl (8)
SbCl3 + 3Na2S4 изб. ® Na3[SbS4] + 3NaCl + 8S¯ (9)