
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Правило Зайцева – термодинамический или кинетический контроль?
|
|
Смесь изомерных несимметричных алкенов – B и C – получена в результате превращений:
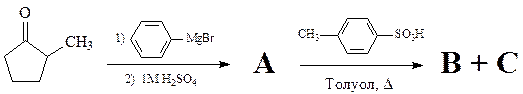
B – менее замещённый алкен.
1. Изобразите структуры веществ A, B и C (без стереохимии).
Вторую стадию – обратимую каталитическую дегидратацию вещества A – можно описать с помощью кинетической схемы:
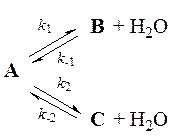
2. Найдите связь между константой равновесия K 1 реакции A ⇄ B и константами скорости отдельных стадий.
3. Используя кинетический закон действующих масс, выразите скорости образования веществ B и C через концентрации участвующих в реакции веществ. Определите, чему равно отношение [ B ] / [ C ]: а) в начале реакции, когда обратными реакциями можно пренебречь; б) в конце реакции, когда устанавливается равновесие между реагентом и продуктами.
4. При 60 °С в начале реакции содержание B в смеси изомеров составляет 55 %, а через 2 ч, когда состав смеси перестаёт меняться, доля B снижается до 9 %. Какой принцип – кинетический или термодинамический – определяет в данном случае правило Зайцева для преимущественного образования несимметричных алкенов? Кратко объясните.
5. При 70 °С содержание B в начале и в конце реакции составляет 50 % и 11 % соответственно. Определите, чему равны значения E 1 и D H (в кДж/моль) на изображённой ниже энергетической диаграмме.
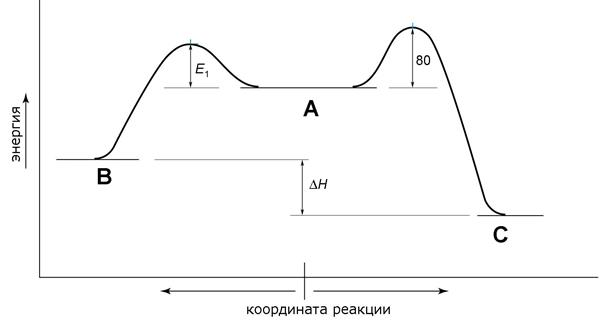
Необходимые уравнения:
Зависимость константы скорости от температуры: ln k = const – E / RT.
Зависимость константы равновесия от температуры: ln K = const – D H / RT.