
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Электродный потенциал и разность потенциалов между электродами
|
|
Если металлический стержень, сделанный из некоторого металла поместить в водный раствор соли этого же металла, то в такой системе будут протекать две противоположно направленные реакции – окисления атомов металла и восстановление катионов металла:
M0 – ne = Mn+
Mn+ + ne = M0
Способность металлов к окислению зависит от химической природы металла и увеличивается справа налево в электрохимическом ряду напряжений (рис….).
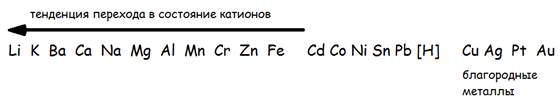
Рис….Электрохимический ряд напряжений металлов (Химия, 2000)
В результате окисления атомов металла, на металлическом стержне концентрируются электроны, а вблизи поверхности металла в растворе концентрируются катионы металла.
В результате возникает двойной электрический слой, а на границе раздела металл-раствор появляется разность электрических потенциалов.
Электрический потенциал– работа внешних электростатических сил по перемещению единичного положительного заряда из точки с 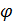 = 0 в данную точку (Морозов и др., 2003).
= 0 в данную точку (Морозов и др., 2003).
Систему, состоящую из металла и раствора электролита в который металл погружен, называют электродом, а потенциал 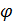 , возникший на границе раздела такой системы – электродным потенциалом (гальвани-потенциалом).
, возникший на границе раздела такой системы – электродным потенциалом (гальвани-потенциалом).
Абсолютное значение разности потенциалов, возникающее на границе металл/электролит измерить нельзя, так она возникает между двумя фазами разной природы. (Химия, 2000).
Устройство, состоящее из двух электродов, называется гальваническим элементом (рис.…).
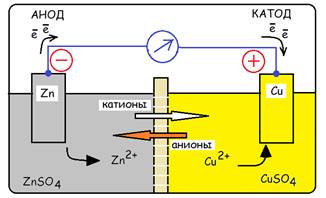
Рис… Гальванический элемент Даниэля
Если принять один из электродов за электрод сравнения, то можно измерить разность гальвани-потенциалов между двумя электродами. Например, разность гальвани-потенциалов элемента Даниэля равна:
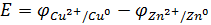
Таким образом, электродвижущая сила электрохимической ячейки E = 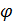 Ox -
Ox - 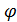 Red – это максимальная работа, совершаемая электрохимической цепью (Аэ/х) при перемещении единичного заряда по внешней цепи от анода к катоду (Морозов и др., 2003):
Red – это максимальная работа, совершаемая электрохимической цепью (Аэ/х) при перемещении единичного заряда по внешней цепи от анода к катоду (Морозов и др., 2003):
Аэ/х = QE = neNАE, где
Q – общий заряд n молей электронов;
e – заряд одного электрона;
NA – число Авогадро.
Заряд одного моля электронов является величиной постоянной, носит название число Фарадея (F) и рассчитывается по формуле:
F = e ·NA = 1.60218·10-19Кл·6.022045·1023моль-1 = 96484.6 Кл/моль
Таким образом,
Аэ/х = neNАE = nFE.
Энергия Гиббса (G) – это максимальная полезная работа, которую может совершить система при постоянных давлении (р) и температуре (Т), т. е.:
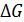 = - Аэ/х = -nEF
= - Аэ/х = -nEF
Знак “-“ перед величиной Аэ/х соответствует термодинамической системе знаков и означает, что система совершает работу Аэ/х над окружающей средой. Указанное равенство выполняется для обратимых равновесных окислительно-восстановительных процессов, в которых отсутствуют другие виды работ (кроме работы расширения рΔ V) ((Морозов и др., 2003).
Таким образом, уравнение
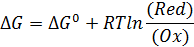
может преобразовать следующим образом:
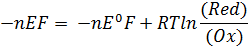
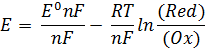
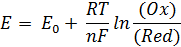
Величина E характеризует глубину и направление протекания реакции аналогично Δ G (Морозов и др., 2003):
при E > 0, Δ G < 0 - самопроизвольный процесс протекает в прямом направлении (слева направо);
при E < 0, Δ G > 0 - самопроизвольный процесс протекает в обратном направлении (справа налево);
при E = 0, Δ G = 0- редокс-система находится в состоянии равновесия.