
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Расчет процесса конверсии
|
|
Рассчитать процесс конверсии метана водяным паром по следующим данным:
| Производительность по метану | 1000 м3/час |
| Состав газа | метан – 98% |
| азот – 2% | |
| Степень конверсии | 70% |
| Температура | на входе 105°С |
| на выходе 900°С |
СН 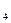 + Н
+ Н 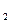 О
О 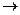 СО + 3Н
СО + 3Н 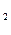

1. Расчет термодинамических параметров.
СН 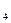
| Н 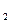 О О
| СО | Н2 | |
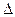 Н Н 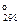 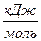
| -74, 85 | -241, 81 | -110, 53 | |
DS 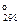 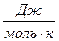
| 186, 27 | 188, 72 | 197, 55 | 130, 52 |
DG 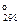 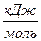
| -50, 85 | -228, 61 | -137, 15 |
1.1. По закону Гесса находим тепловой эффект химической реакции при нормальных условиях:
DН 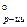 =(Sni DН
=(Sni DН 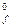 )
) 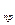 - (Sni DН
- (Sni DН 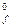 )
) 
DН 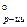 = 0× 3 - 110, 53 + 241, 81 + 74, 85 = 206, 13 кДж/моль
= 0× 3 - 110, 53 + 241, 81 + 74, 85 = 206, 13 кДж/моль
1.2. Найдем энтропию реакции:
DS 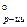 = (SniDS
= (SniDS 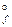 )
) 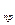 - (SniDS
- (SniDS 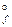 )
) 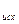
DS 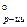 =3× 130, 52 +197, 55 -188, 72 -186, 27= 214, 12 Дж/моль× К
=3× 130, 52 +197, 55 -188, 72 -186, 27= 214, 12 Дж/моль× К
1.3. Найдем изменение энергии Гиббса в ходе реакции при нормальных условиях:
DG 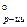 = (SniDG
= (SniDG 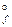 )
) 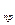 -(SniDG
-(SniDG 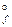 )
) 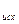
DG 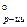 = 3× 0-137, 15+288, 61+50, 85=142, 31 кДж/моль
= 3× 0-137, 15+288, 61+50, 85=142, 31 кДж/моль
2. Найдем функцию зависимости теплоемкости от температуры С 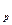 = f(Т)
= f(Т)
СН 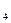
| Н 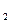 О О
| СО | Н 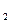
| |
| a | 14, 32 | 28, 41 | 27, 28 | |
| b | 74, 66× 10 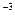
| 10, 71× 10 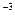
| 4, 1× 10 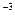
| 3, 26× 10 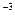
|
| с’ | 0, 33× 10 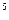
| -0, 46× 10 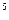
| 0, 5× 10 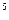
| |
| с | -17, 43× 10 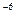
|
Ср(СН4) = 14, 32 + 74, 66× 10 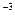 Т - 17, 43× 10
Т - 17, 43× 10 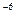 Т
Т 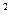
Ср(Н2О) = 30 + 10, 71× 10-3Т + 0, 33× 105Т-2
Ср(СО) = 28, 41+ 4, 1× 10-3× Т - 0, 46× 105Т-2
Ср(Н2) = 27, 28 + 3, 26× 10-3Т + 0, 5× 105Т-2
DСр = Dа + DbT + Dс’Т2+DcТ-2
DСр = (3× 27, 28+28, 41-30-14, 32) + (3× 3, 26+4, 1-10, 71-74, 66)× 10-3Т +
+ (3× 0, 5-0, 46-0, 33)× 105Т-2 - 17, 43× 10-6Т2
DСр = 65, 93 - 71, 49× 10-3Т + 0, 71× 105Т-2 - 17, 43× 10-6Т2 Дж/моль× К
2.1. Для азота зависимость теплоемкости от температуры выглядит следующим образом:
Ср(N2) = 27, 88 + 4, 27× 10-3Т
3.1. Найдем изменение энтропии в ходе реакции при нагревании от t1=25 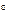 C до t2=900
C до t2=900 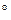 C:
C:
DS= 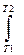
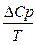 dТ =
dТ =
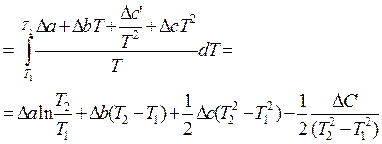
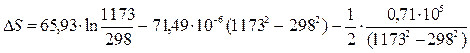
DS=16.54 Дж/моль× К
3.2. Найдем изменение энтальпии в ходе реакции при нагревании от t1=25°C до t2=900°C:
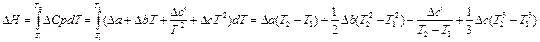
DH= 65, 93 (1173-298) - 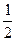 × 71, 49× 10-3(11732-2982) -
× 71, 49× 10-3(11732-2982) - 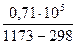 -
- 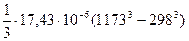
DН= - 2375 Дж/моль
3.3. Рассчитаем энергию Гиббса на выходе t2=900°С:
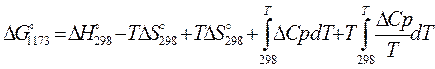
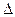
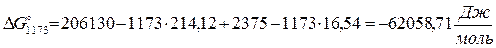
4. Найдем константу равновесия:
DG°=-RTlnKp
Kp = exp(-DG°/RT)
Kp=exp(-(-62058, 71/8, 31× 1173))=582, 04
4.1. Рассчитаем равновесную степень превращения метана. При температуре от 827°С и составе исходной смеси СН4 : Н2О = 1: 2 необходимо проводить процесс при абсолютном давлении 10 атм.
СН4 + Н2О ® СО + 3Н2
т.к. водяной пар в избытке, то РН2О = 2РСН4
Робщ = РСН4 + 2РСН4= 3РСН4
РСН4 = Робщ/3 = 10/3 атм.
При равновесии:
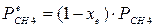
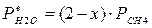
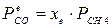
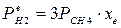
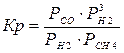
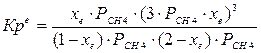
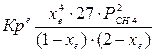
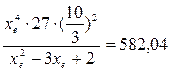
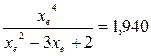
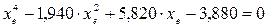
xe = 0, 8115 и xe = - 2, 29
Равновесная степень превращения равна 0, 8115.
Вывод: равновесная степень превращения метана xe=0, 8115, степень конверсии a = 0, 7, данный процесс, возможно, провести в указанных условиях.
5. Составим материальный баланс.
| Приход | Расход | ||||
| Исходное вещество | m, кг | V, м3 | Продукт | m, кг | V, м3 |
| СН4 | 714, 29 | СН4 | 214, 29 | ||
| N2 | 25, 51 | 20, 41 | N2 | 25, 51 | 20, 41 |
| Н2О | 1607, 14 | Н2О | 1044, 64 | ||
| СО | |||||
| Н2 | 187, 5 | ||||
| Итого: | 2346, 94 | 3020, 41 | Итого: | 2346, 94 | 4420, 41 |
5.1.Найдем количество поступающего метана (в час):
по закону эквивалентов
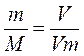
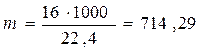 (кг)
(кг)
Найдем количество конвертируемого метана:
V=0, 7× 1000=700 (м3)
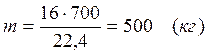
После реакции осталось:
m(СН4) = 714, 29 – 500 = 214, 29 (кг)
V(СН4)= 1000 – 700 = 300 (м3)
5.2. Найдем необходимое количество воды для осуществления реакции:
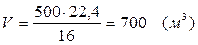
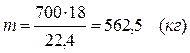
В промышленном производстве для осуществления процесса воду и метан берут в отношении 2: 1. Исходя из этого условия рассчитаем количество поступающего водяного пара:
V = 2 × 1000 = 2000 (м3)
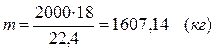
Не прореагировало водяного пара:
m(Н2О) = 1607, 14 – 500 = 214, 29 (кг)
V(Н2О) = 2000 – 700 = 300 (м3)
5.3. В реактор поступает  :
:
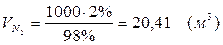
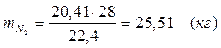
Т.к. азот не участвует в химической реакции, то на выходе:
m = 25, 51 (кг)
V = 20, 41 (м3)
5.4. Найдем количество образовавшегося в ходе реакции СО:
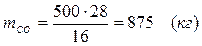
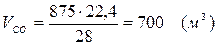
5.5. Найдем количество образовавшегося водорода:
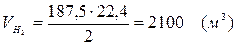
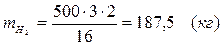
Вывод: 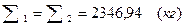 . Материальный баланс сошелся.
. Материальный баланс сошелся.
6. Составим энергетический баланс:
| Приход | кДж | % | Расход | кДж | % |
| Q(СН4) | 675, 87 | Q(СН4) | 1224, 04 | 7, 2 | |
| Q(N2) | 10, 16 | 0, 06 | Q(N2) | 35, 15 | 0, 2 |
| Q(Н2О) | 1156, 9 | 6, 87 | Q(Н2О) | 4460, 2 | 26, 4 |
| Qподв | 15029, 6 | 89, 07 | Q(СО) | 1216, 5 | 7, 23 |
| Q(Н2) | 3420, 87 | 20, 24 | |||
| Qх.р. | 6515, 8 | 38, 62 | |||
| Итого: | 16872, 53 | 100% | Итого: | 16872, 56 | 100% |
6.1. Найдем тепло, которое поступает с исходными веществами – физическое тепло:
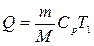
где T1 – температура на входе, (t1=105 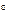 C); Ср – теплоемкость, будем считать, что теплоемкость зависит от температуры (п.2).
C); Ср – теплоемкость, будем считать, что теплоемкость зависит от температуры (п.2).
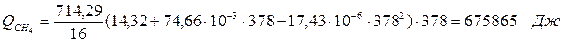
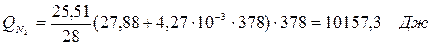
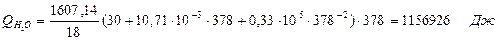
Реакция конверсии водяным паром сильно эндотермична, поэтому необходимо подогревать исходную реакционную смесь. В промышленности для подогрева системы используют природный газ, за счет сжигания которого выделяется необходимое количество тепла Q.
6.2. Найдем тепло веществ на выходе из реактора:
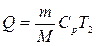
где T2 – температура на выходе из реактора.
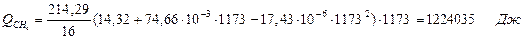
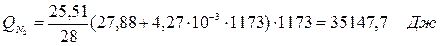
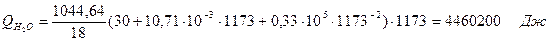
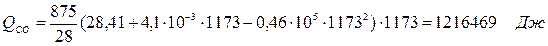
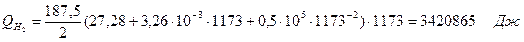
6.3. Найдем теплоту, поглощенную в ходе химической реакции:
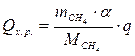
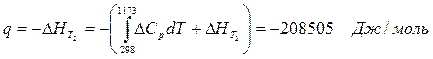
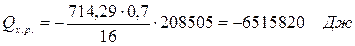
6.4. Найдем количество теплоты, которое необходимо затратить на подогрев исходной смеси:
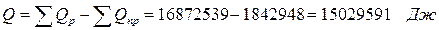
6.5. Найдем количество природного газа, которое необходимо затратить для подогрева исходной смеси, считая, что природный газ на 95% состоит из метана (состав природного газа зависит от месторождения, колеблется от 55-99%):
По справочнику:
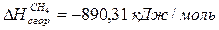
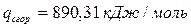
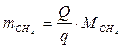
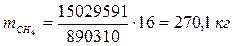
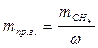
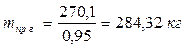
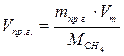
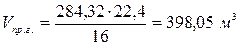
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. А. Г. Аншиц, Е. Н. Воскресенская. Окислительная конденсация метана – новый процесс переработки природного газа.
2. Сосна М.Х., Энтин Б.М., Лейтес И.Л. Нонограммы для определения состава газа конверсии метана//Химическая промышленность. – 1989. - №7. - с.59
3. Крейндель Э.М. Конверсия метана природного газа. Л.: -1964.
4. Г.С. Яблонский. Кинетические модели гетерогенно-каталитических реакций. Элементы теории кинетики сложных химических реакций. Глава 1. В сб.: Химическая и биологическая кинетика / Под ред. Н.М. Эмануэля, И.В. Березина, С.Д. Варфоломеева. М.: Изд-во Моск. ун-та, 1983.
5. Водород. Свойства, получение, хранение, транспортирование, применение: Справ. изд./Д.Ю. Гамбург, В.П. Семенов,, Л.Н. Смирнова; Под ред. Д.Ю. Гамбурга, Н.Ф. Дубовкина. – М.: Химия, 1989.