
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основные положения Молекулярно кинетической теории. Уравнение состояния идеального газа. Изопроцессы
|
|
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
В основе молекулярно-кинетической теории лежат три основных положения:
1. Все тела состоят из мельчайших частиц – молекул и атомов. Масса любого тела есть величина дискретная, кратная массе составляющих его частиц.
2. Атомы и молекулы находятся в непрерывном хаотическом движении.
3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение.
Постоянное хаотичное движение молекул вещества проявляется также в другом легко наблюдаемом явлении – диффузии. Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друг в друга. Наиболее быстро процесс протекает в газе, если он неоднороден по составу. Диффузия приводит к образованию однородной смеси независимо от плотности компонентов.
Молекулы имеют чрезвычайно малые размеры. Простые одноатомные молекулы имеют размер порядка 10–10 м. Беспорядочное хаотическое движение молекул называется тепловым движением.
Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0, 012 кг углерода 12C. Молекула углерода состоит из одного атома.
Таким образом, в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NА: NА = 6, 02·1023 моль–1
Уравнение состояния устанавливает связь между термодинамическими параметрами, определяющими состояние идеального газа. Состояние идеального газа определено если известны давление, объем и температура.
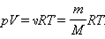 уравнение состояния идеального газа или уравнением Менделеева- Клапейрона
уравнение состояния идеального газа или уравнением Менделеева- Клапейрона
R универсальная газовая постоянная. Ее численное значение в СИ есть: R=kNA = 8, 31 Дж/моль·К
Если температура газа равна T н = 273, 15 К (0 °С), а давление p н = 1 атм = 1, 013·105 Па, то говорят, что газ находится при нормальных условиях. Как следует из уравнения состояния идеального газа, один моль любого газа при нормальных условиях занимает один и тот же объем V 0, равный V 0 = 0, 0224 м3/моль = 22, 4 дм3/моль. Это утверждение называется законом Авогадро.
Для смеси невзаимодействующих газов уравнение состояния принимает вид pV = (ν 1 + ν 2 + ν 3 +...) RT, где ν 1, ν 2, ν 3 и т. д. – количество вещества каждого из газов в смеси.
Процессы, в которых один из параметров (p, V или T) остается неизменным называются изопроцессами.
1. Изотермический процесс (T = const), pV = const
На плоскости (p, V) изотермические процессы изображаются при различных значениях температуры T семейством гипербол p ~ 1 / V, которые называются изотермами. Изотермы, соответствующие более высоким значениям температуры, располагаются на графике выше изотерм, соответствующих меньшим значениям температуры. T 3 > T 2 > T 1. Уравнение изотермического процесса называют законом Бойля–Мариотта
2. Изохорный процесс (V = const) 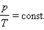
На плоскости (p, T) изохорные процессы для заданного количества вещества ν при различных значениях объема V изображаются семейством прямых линий, которые называются изохорами. Большим значениям объема соответствуют изохоры с меньшим наклоном по отношению к оси температур V 3 > V 2 > V 1. Уравнение изохорного процесса называется законом Шарля.
Изобарный процесс (p = const) 
На плоскости (V, T) изобарные процессы при разных значениях давления p изображаются семейством прямых линий, которые называются изобарами. p 3 > p 2 > p 1
Уравнение изобарного процесса называют законом Гей-Люссака.
Литература
1. Детлаф А.А., Яворский Б.М, Курс физики: Уч. пос. для втузов. Изд. 4-е, испр. - 607 с. М: Высшая Школа, 1989г.
2. Трофимова Т.И. Краткий курс физики: Уч. пос. для вузов. Изд. 2-е, испр. – 352 с, М: Высшая Школа, 2002 г.
3. Савельев И.В. Курс общей физики. Механика. Молекулярная физика. 350с, т. М.Наука. 1989.
Лекция №6 (тезисы)