
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач. 1.Определите эквивалент и молярные массы эквивалентов элементов в соединениях: .
|
|
1.Определите эквивалент и молярные массы эквивалентов элементов в соединениях: 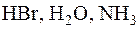 .
.
Решение. В указанных соединениях с формульной единицей водорода соединяется 1 формульная единица брома, ½ формульной единицы кислорода и 1/3 формульной единицы азота. Следовательно, согласно закону эквивалентов, эквиваленты брома, кислорода и азота равны соответственно 1 формульной единице брома, ½ формульной единице кислорода и 1/3 формульной единице азота, а числа эквивалентности zB для атомов брома, кислорода и азота равны, соответственно, 1, 2 и 3. Исходя из молярных масс атомов этих элементов, находим, что молярная масса эквивалентов атомов брома равна: 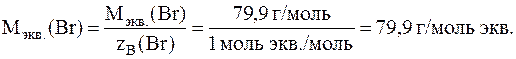
Молярная масса эквивалентов атомов кислорода равна:
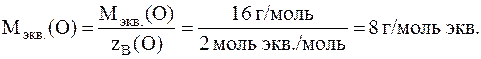
Молярная масса эквивалентов атомов азота равна:
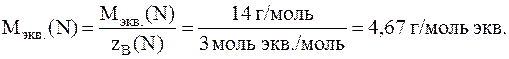
2. На восстановление 1, 80 г оксида металла израсходовано 896 мл водорода, измеренного при нормальных условиях. Вычислить молярные массы эквивалентов оксида и металла.
Решение. Поскольку вещества реагируют в эквивалентном отношении 1: 1 (закон эквивалентов), то количества вещества эквивалентов водорода и оксида должны быть равны.
Вычислим количество вещества эквивалентов водорода. Для этого сначала найдем молярный объем эквивалентов водорода при нормальных условиях (н.у.):
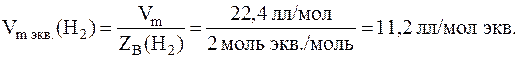
Зная молярный объем эквивалентов водорода, найдем количество вещества эквивалентов водорода, содержащихся при н.у. в 0, 883 л этого газа:
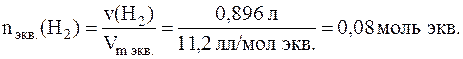
В соответствии с законом эквивалентов количество вещества эквивалентов оксида также равно 0, 08 моль экв.
Найдем молярную массу эквивалентов оксида:
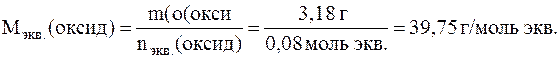
Поскольку в эквиваленте оксида металла содержится один эквивалент металла и один эквивалент кислорода, то и молярная масса эквивалентов оксида металла равна сумме молярных масс эквивалентов металла и кислорода:
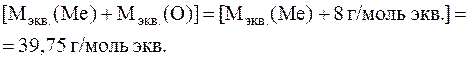
где: 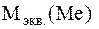 – молярная масса эквивалентов металла;
– молярная масса эквивалентов металла;
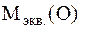 =8 г/моль экв. – молярная масса эквивалентов кислорода;
=8 г/моль экв. – молярная масса эквивалентов кислорода;
Отсюда:
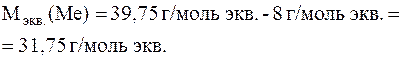
Такое значение молярной массы эквивалентов имеет медь.
3. Определите стандартную теплоту сгорания 1 моля метана, исходя из стандартных энтальпий образования этого вещества и продуктов его сгорания.
Решение. Запишем уравнение реакции сгорания метана:
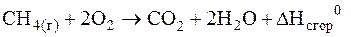
Согласно следствию из закона Гесса, тепловой эффект этой реакции будет равен разности энтальпий образования продуктов реакции и исходных веществ:
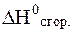 = 1 моль ·
= 1 моль · 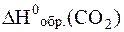 + 2 моль·
+ 2 моль· 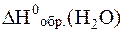
- 1 моль· 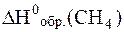
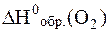 = 0 кДж/моль (как и для других простых веществ устойчивых при стандартных условиях).
= 0 кДж/моль (как и для других простых веществ устойчивых при стандартных условиях).
Находим стандартные энтальпии образования в таблице 2 приложения 3:
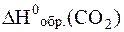 = -393, 5 кДж/моль = -393, 5 кДж/моль
| 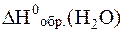 = - 241, 8 кДж/моль = - 241, 8 кДж/моль
|
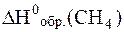 = - 74.9 кДж/моль = - 74.9 кДж/моль
|
Подставим найденные величины в уравнение:
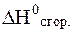 =1 моль·(-393, 5 кДж/моль) – 2 моль·(-241, 8)·кДж/моль + 1 моль ·74, 9 кДж/моль = -802, 2кДж
=1 моль·(-393, 5 кДж/моль) – 2 моль·(-241, 8)·кДж/моль + 1 моль ·74, 9 кДж/моль = -802, 2кДж
Поскольку тепловой эффект реакции вычислялся для сгорания 1 моля метана, то стандартная теплота сгорания метана равна = -802, 2кДж/моль
4. Определите, как изменяется скорость реакции 2СО + О2 = 2СО2 если общее давление в системе уменьшить в 2 раза.
Решение. Согласно закону действия масс скорость реакции равна:
v1 = k[с(CO)]2с(O2)
Уменьшение давления в системе в два раза равноценно уменьшению вдвое концентрации реагирующих веществ. Поэтому после уменьшения давления скорость реакции составит:
v2 = k[0, 5·с(CO)]2[0, 5·с(O2)] = 0, 25·0, 5· k[с(CO)]2с(O2) =
0, 125· v1
v2/ v1 = 0, 125· v1/ v1 = 1/8
Таким образом, после уменьшения давления в 2 раза скорость реакции уменьшится в 8 раз.
5. Температурный коэффициент скорости реакции равен 2, 8. Во сколько раз возрастет скорость реакции при повышении температуры от 20 до 500С?
Решение. Согласно правилу Вант-Гоффа:
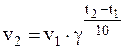 ,
,
где:
v1 – скорость реакции при температуре t1 (в нашем случае 20 0 С);
v2 – скорость реакции при температуре t2 (в нашем случае 50 0 С);
γ – температурный коэффициент скорости реакции (в нашем случае 2, 8).
Подставляя заданные значения величин в уравнение, получим:
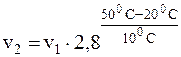 , отсюда:
, отсюда: 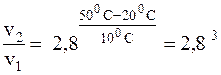
Прологарифмируем обе части уравнения (воспользовавшись, например, программой «Инженерный калькулятор» «Windows»):
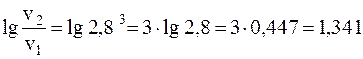 , отсюда:
, отсюда: 
Таким образом, скорость реакции увеличится в 21, 9 раза.
6. Найти массу воды и массу 20%-ного раствора сульфата меди (CuSO4) с массовой долей растворенного вещества 20%, необходимых для приготовления 1 л раствора с массовой долей сульфата меди 8%. Плотность 8% раствора CuSO4 равна 1, 084 г/мл.
Решение. Найдем массу содержащегося в конечном растворе сульфата меди. Для этого запишем формулу для вычисления массовой доли растворенного вещества. Преобразуем эту формулу, выразив массу конечного раствора через произведение его объема на плотность. В полученное выражение подставим значения приведенных в условии величин:
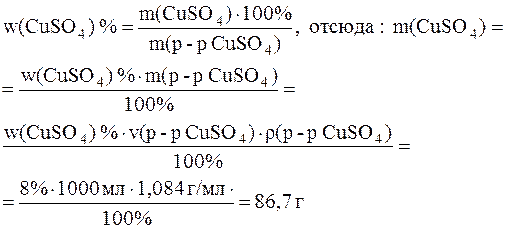
Поскольку сульфат меди приходит в конечный раствор из исходного раствора с массовой долей соли 20%, то для этого раствора справедливо следующее выражение:
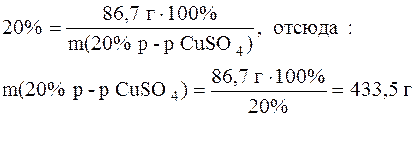
Масса воды, необходимой для приготовления конечного раствора, найдется путем вычитания из массы конечного раствора массы 20%-ного раствора сульфата меди:
1, 084 г/мл ∙ 1000 мл – 433, 5 г = 650, 5 г
Таким образом, для приготовления искомого раствора нужно взять 433, 5 г 20%-ного раствора сульфата меди и 650, 5 г воды.
7. Вычислите осмотическое давление, а также понижение температуры замерзания раствора, в литре которого содержится 18 г глюкозы C6H12O6 при 00C. Криоскопическая константа воды составляет 1, 850С·кг/моль.
Решение. Согласно закону Вант-Гоффа осмотическое давление равно:
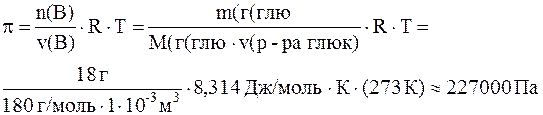
Согласно второму закону Рауля – понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора:
Δ T = K Cm (B) = 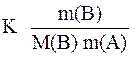
где: K - криоскопическая или эбулиоскопическая константа;
m(B) – масса растворенного вещества, г;
m(A) – масса растворителя, кг;
M(B) – молярная масса растворенного вещества, г/моль.
Поскольку концентрация глюкозы в растворе мала, то в 1 л раствора содержится приблизительно 1 кг воды (как и в 1 литре чистой воды). Тогда понижение температуры замерзания раствора составит:
Δ Tзам. = Kкр Cm (B) =
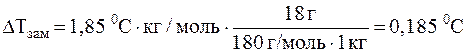
8. Найти степень диссоциации хлорноватистой кислоты (НОСl) в 0, 2 М растворе. Значение константы диссоциации хлорноватистой кислоты: К=5, 0 10-8.
Решение. Для расчета степени диссоциации используем закон разбавления Оствальда (для случаев, когда степень диссоциации электролита, диссоциирующего на два иона, очень мала):
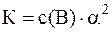 , откуда:
, откуда: 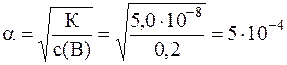
Таким образом, степень диссоциации хлорноватистой кислоты: α = 5· 10-4.
9. Определите концентрацию ионов водорода в растворе, рН которого равен 4.
Решение. Согласно условию задачи, pH = -lg[H+] = 4. Следовательно, lg[H+] = - 4. Отсюда: [H+] =10-4 моль/л.
10. Чему равна концентрация гидроксид–ионов в растворе, рН которого равен 10?
Решение. Из ионного произведения воды: [H+]·[OH-] = 10-14 выразим концентрацию гидроксид-ионов: [OH-] = 10-14 / [H+]
Поскольку pH = -lg [H+] = 10, то [H+] = 10-10
Подставив это значение в предыдущее уравнение получим:
[OH-] = 10-14 / 10-10 = 10-4 (моль/л)
Таким образом, концентрация гидроксид-ионов в этом растворе составляет 10-4 моль/л
11. Сколько времени потребуется для полного разложения в электролизере 2 молей воды электрическим током силой 2 А?
Решение. В электролизере на аноде и катоде происходят следующие процессы:
А: 2H2O – 4ē → 4H+ + O2↑
К: 4H2O + 4ē → 4OH- + 2H2↑
2H2O→ 2H2↑ - + O2↑
В соответствии с законами Фарадея: 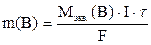 ,
,
где m–масса вещества B, претерпевшая электрохимическое превращение, г; Мэкв. – молярная масса электрохимических эквивалентов вещества B, г/моль экв.; F – число Фарадея, F=96500 Кл/моль экв.; I – ток, А.
Выразим из этой формулы время:
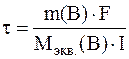
Для вычисления молярной массы электрохимических эквивалентов воды учтем, что ее разложение протекает и на аноде, и на катоде. Как это следует из суммарного уравнения реакций, при прохождении через электролизер 4 моль электронов на аноде и катоде суммарно разлагается 2 моль воды, отсюда:
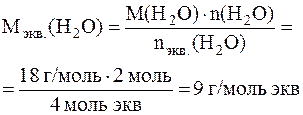
Масса 2 моль воды: m(H2O) = 2 моль ∙ 18 г/моль = 36 г
Отсюда:
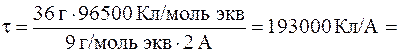
=193000 с (или 53, 6 ч).
12. Стальная деталь покрыта слоем хрома. Какие коррозионные процессы будут происходить, если покрытие будет механически нарушено (например, вследствие царапины)? Приведите схему образующихся при этом гальванических элементов и рассчитайте их ЭДС для случаев кислой и нейтральной сред.
Решение. При проявлении царапины на покрытии возникает гальванический элемент: железо – хром. Катодом (электродом, на которым происходит процесс восстановления) станет электрод с большим стандартным электродным потенциалом. Находим значения стандартных электродных потенциалов в таблице 2 Приложения:
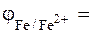 - 0, 440 В;
- 0, 440 В;
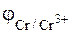 = - 0, 744 В.
= - 0, 744 В.
Большее значение имеет стандартный электродный потенциал железа. Следовательно, катодом будет железо, а анодом, т.е. электродом на котором происходит процесс окисления, хром.
А: Cr – 3 ē → Cr3+
Теперь необходимо выяснить какие частицы восстанавливаются на катоде. В зависимости от среды это либо ионы водорода (кислая среда), либо кислород (нейтральная среда). Источником этих веществ является атмосфера.
K: 2H+ + 2 ē → H2 (кислая среда),  0 В
0 В
K: O2 +2H2O + 4 ē → 4OH- (нейтральная среда), 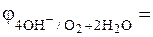 + 0, 401 В
+ 0, 401 В
Таким образом, в кислой среде возникнет следующий коррозионный гальванический элемент, в котором будет окисляться хром (анод), а восстанавливаться ионы водорода (катод):
 , ЭДС которого в стандартных условиях:
, ЭДС которого в стандартных условиях:
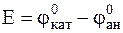 = 0 – (- 0, 744 В) = 0, 744 В.
= 0 – (- 0, 744 В) = 0, 744 В.
В нейтральной среде возникнет коррозионный гальванический элемент, в котором будет окисляться хром (анод), а восстанавливаться кислород (катод):
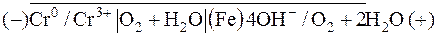
ЭДС этого элемента:
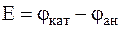 = +0, 401-(-0, 744) = 1, 145 В.
= +0, 401-(-0, 744) = 1, 145 В.