
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Состав и характеристика атомного ядра
|
|
Атомное ядро состоит из элементарных частиц — протонов и нейтронов. Протон (р) имеет положительный заряд, равный заряду электрона, и массу покоя mp=1, 6726•10-27 кг»1836me, где me — масса электрона. Нейтрон (n) — нейтральная частица с массой покоя mn=1, 6749•10-27кг»1839me,. Протоны и нейтроны называются нуклонами (от лат. nucleus — ядро). Общее число нуклонов в атомном ядре называется массовым числом А. Атомное ядро характеризуется зарядом Ze, где е — заряд протона, Z — зарядовое число ядра, равное числу протонов в ядре и совпадающее с порядковым номером химического элемента в Периодической системе элементов Менделеева. Известные в настоящее время 107 элементов таблицы Менделеева имеют зарядовые числа ядер от Z=1 до Z=107. Ядро обозначается тем же символом, что и нейтральный атом: AZХ, где X — символ химического элемента, Z — атомный номер (число протонов в ядре), А — массовое число (число нуклонов в ядре). Сейчас протонно-нейтронная модель ядра не вызывает сомнений. Рассматривалась также гипотеза о протонно-электронном строении ядра, но она не выдержала экспериментальной проверки. Так, если придерживаться этой гипотезы, то массовое число А должно представлять собой число протонов в ядре, а разность между массовым числом и числом электронов должна быть равна заряду ядра. Эта модель согласовывалась со значениями изотопных масс и зарядов, но противоречила значениям спинов и магнитных моментов ядер, энергии связи ядра и т. д. Кроме того, она оказалась несовместимой с соотношением неопределенностей. В результате гипотеза о протонно-электронном строении ядра была отвергнута.
 (Z-зарядовое число=заряду ядра=№ в таблице Менделееве, А- массовое число)
(Z-зарядовое число=заряду ядра=№ в таблице Менделееве, А- массовое число)
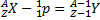
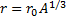 -радиус ядра,
-радиус ядра, 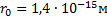
Атомное ядро атома любого химического элемента состоит из положительно заряженных протонов и не имеющих электрического заряда нейтронов. Заряд протона по абсолютной величине равен заряду электрона. Протон и нейтрон являются двумя зарядовыми состояниями ядерной частицы, которая называется нуклоном. Количество протонов в ядре Z (заряд ядра Ze) совпадает с атомным номером соответствующего химического элемента в периодической системе Менделеева (VI.2.9.Г). Количество нейтронов в ядре обозначается N. Для всех ядер N^Z (за исключением }Н, ЦНе (п. 2°)). Для легких ядер, находящихся в первой половине периодической системы Менделеева, NlZ-zz 1; ядра атомов химических элементов, находящихся в конце периодической системы, перегружены нейтронами —для них N/Zfv 1, 6.
2°. Массовым числом ядра А называется общее число нуклонов в ядре: Л=2+А/. Символ для обозначения ядра: |Х, где X — обозначение атома данного химического элемента в периодической системе Мендлеева. Ядра с одним и тем же зарядом Ze, но с разными А, называются изотопами. Изотопы ядер данного химического элемента имеют разное число нейтронов в ядре. Примеры: изотопы водорода: JH, (или iD — дейтерий), JH (или — тритий); изотопы гелия: |Не, |Не; изотопы урана: sI6U, ifU.
Существует около трехсот устойчивых и около двух тьь сяч неустойчивых (радиоактивных) изотопов всех известных химических элементов.
3°. Масса атомного ядра практически совпадает с массой всего атома, ибо масса электронов в атоме мала. Масса электрона *) те составляет 1/1836 от массы протона /и,,.
[1] Все сведения о массах, приведенные в главе 4, относятся к массам покоя (V.4.10.3°), если нет специальных оговорок.
Массы нейтрона тл и протона mv в углеродной шкале атомных масс (а. е. м.) (VII.7.1°):
та = 1, 00865017 (37) а. е. м., т9 = 1, 007276470 (11) а. е м
Числа в круглых скобках представляют собой среднеквадратичные погрешности в последних цифрах.
Массовые числа нейтрона и протона одинаковы и равны единице.
Массы атомов измеряются в специальных атомных единицах массы (VII.7.Г).
У каждого химического элемента существует, в большинстве случаев, постоянное процентное содержание различных изотопов. Химически чистые элементы представляют собой смесь изотопов, отличающихся друг от друга относительными атомными массами (VI 1.4.3°). Поэтому каждый химический элемент имеет относительную массу, представляющую собой среднее значение относительных атомных масс всех его изотопов. Относительные атомные массы химических элементов в ряде случаев заметно отличаются от целых чисел.
4\ Ядро имеет спин — собственный (внутренний) момент количества движения (момент импульса) (ср. 111.6.1.5"). Он складывается из спинов отдельных нуклонов. Спин каждого нуклона равен Й/2. Спин ядра, состоящего из четного числа нуклонов, является целым числом (в единицах fi) или нулем. Спин ядра, состоящего из нечетного числа нуклонов, является полуцелым (в единицах ft).
5°. Атомное ядро не имеет резко выраженных границ. Это связано с тем, что нуклоны обладают волновыми свойствами (VI. 1.1.3°). Поэтому размер ядра имеет условный смысл *). Объем ядра пропорционален числу нуклонов Л в ядре. Если считать ядро сферой радиуса R, то R вычисляется по эмпирической формуле
R = RtA«*, где £, = (1, 3-М, 7).10-»м.
Наиболее тяжелые ядра, например ядро урана, имеют радиусы, приближающиеся по порядку величины к Ю-*4 м.
6°. Средняя плотность р ядерного вещества определяется формулой
_ м « р ~ (4/3)я/? 9'
[1] Это относится также и к размерам атома, ибо электроны, движущиеся в атоме относительно ядра, тоже обладают волновыми свойствами.
Здесь М9 — масса ядра. Если //? „ — масса нуклона *), то Мя=т„А. Средняя плотность ядерного вещества постоянна и не зависит от числа А нуклонов в ядре; р= = 1, 3-1017 кг/м3. Колоссальная средняя плотность р не идет ии в какое сравнение с обычными плотностями веществ, состоящих из атомов химических элементов и их соединений.