
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Г. Регуляция синтеза пуриновых нуклеотидов
|
|
Основным показателем, от которого зависит синтез пуриновых нуклеотидов, служит концентрация ФРДФ, которая, в свою очередь, зависит от скорости его синтеза, утилизации и разрушения. Количество ФРДФ определяется доступностью рибозо-5-фосфата и активностью ФРДФ синтетазы - фермента, чувствительного к концентрации фосфата и пуриновых нуклеотидов. Внутриклеточная концентрация ФРДФ строго регулируется и обычно низкая. ФРДФ синтетаза - аллостерический фермент. Он активируется неорганическим фосфатом (Рi) и ингибируется пуриновыми нуклеозид- моно-, ди- и трифосфатами, которые по эффективности ингибирования распределяются в следующем порядке: НМФ> НДФ > НТФ (рис. 10-8). ФРДФ служит не только субстратом, но и аллостерическим активатором второй реакции синтеза пуринонуклеотидов denovo, которую катализирует амидофосфорибозилтрансфераза.
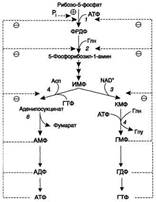 Рис. 10-8. Регуляция синтеза пуриновых нуклеотидов. 1 - ФРДФ синтетаза; 2 - амидофоофорибозилтрансфераза; 3 - ИМФ дегидрогеназа; 4 - аденилосукцинатсинтетаза.
Рис. 10-8. Регуляция синтеза пуриновых нуклеотидов. 1 - ФРДФ синтетаза; 2 - амидофоофорибозилтрансфераза; 3 - ИМФ дегидрогеназа; 4 - аденилосукцинатсинтетаза.
Пуриновые нуклеотиды, особенно АМФ и ГМФ по механизму отрицательной обратной св1язи ингабируютамидофосфорибозилтрансферазу, которая катализирует первую специфическую реакцию синтеза пуриновых нуклеотидов denovo. Метаболическая цепь образования АМФ и ГМФ denovo регулируется также в месте её разветвления: АМФ ингибирует аденилосукцинатсинтетазу, а ГМФ - реакцию образования ксантиловой кислоты, которую катализирует ИМФ дегидрогеназа. Перекрёстная регуляция путей использования ИМФ служит для того, чтобы снизить синтез одного пуринового нуклеотида при дефиците другого.Помимо ферментов основного пути синтеза пуриновых нуклеотидов denovo, регулируется также активность ферментов " запасных" путей: аденинфосфорибозилтрансфераза ингибируется АМФ, а гипоксантин-гуанинфосфорибозилтрансфераза - ИМФ и ГМФ.
46. Биосинтез (репликация ДНК): биохимические механизмы и биологическая роль. Биохимические основы полимеразной цепной реакции.
47. Биосинтез РНК (транскрипция): биохимические механизмы и биологическая роль.
48. Биосинтез белков и пептидов: локализация и биологическая роль. Активация аминокислот, образование аминоацил-тРНК.
49. Функции мРНК в синтезе белка. Этапы процесса трансляции.
50. Посттрансляционная биохимическая модификация белков и пептидов в клетках. Ферментативный гидролиз белков. Протеолитические ферменты. Ограниченный протеолиз белков и пептидов.
51. Пути образования и распада аминокислот. Механизм и биологическое значение переаминирования.
52. Процессы дезаминирования и декарбоксилирования аминокислот.
53. Образование и транспорт аммиака. Восстановительное аминирование. Амиды и их физиологическое значение. Восстановительное аминирование — вид аминирования, при котором карбонильная группа замещается на амин через промежуточный имин. Один из важнейших методов получения аминов, например в фармацевтической промышленности
Образование аммиака.
1. За счет дезаминирования аминокислот
2. При распаде пуриновых и пиримидиновых нуклеотидов.
3. Инактивация биогенных аминов с участием ферментов моноаминооксидаз.
4. В кишечнике а качестве продукта жизнедеятельности микробной микрофлоры (при гниении белков в кишечнике
Дезаминирование - процесс отщепления от аминокислот аминогрупп с образованием свободного аммиака. Дезаминирование в организме человека протекает в 2 вариантах: 1 В виде прямого дезаминирования
2 В виде непрямого дезаминирования (трансдезаминирование)