Приклади розв’язання типових задач з теми 1
Задача 1. За допомогою рівнянь реакцій довести хімічний характер наведених оксидів:
a) CaO, Na2O; б) Al2O3, SnO2; в) V2O5, CrO3, Mn2O7; г) CO2, N2O3 .
Розв’язання. а) Хімічний характер оксиду визначається його відношенням до кислот і лугів.
Na2O, CaO - основні оксиди, отже, вони реагують з кислотами та кислотними оксидами, утворюючи солі, наприклад:
Na2O + 2HNO3 = 2NaNO3 + H2О;
CaO + N2O5 = Ca(NO3)2.
б) Al2O3, SnO2 - амфотерні оксиди. Вони мають двоїстий хімічний характер: залежно від партнера по реакції можуть виявляти і основний, і кислотний характер, утворюючи солі під час взаємодії як з кислотами, так і з основами, наприклад:
Al2O3 + 2NaOH 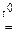 2NaAlO2 + H2O; 2NaAlO2 + H2O;
або Аl2O3 + 6NaOH  2Na3AlO3 + 3H2O; 2Na3AlO3 + 3H2O;
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O;
SnO2 + K2O 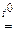 K2SnO3; K2SnO3;
SnO2 + 4HCl = SnCl4 + 2H2O.
в) V2O5, CrO3, Mn2O7 - кислотні оксиди. Отже, вони утворюють солі з основами й основними оксидами, а також з амфотерними оксидами та гідроксидами, які також можуть виявляти основні властивості, наприклад:
V2O5 + 2NaOH = 2NaVO3 + H2O;
Mn2O7 + 2NaOH = 2NaMnO4 + H2O.
Для написання продуктів реакції солеутворення, що відбувається між кислотним оксидом та основою або основним оксидом, до кислотного оксиду треба уявно додати воду, записати формулу відповідної кислоти та визначити заряд кислотного залишку.
Наприклад, у реакції
K2O + СrO3 = …
кислотний оксид - CrO3. Додаючи уявно воду, одержуємо формулу відповідної кислоти
CrO3 × H2O = H2CrO4 (хромова кислота),
а заряд кислотного залишку - СrO42-. Отже, рівняння реакції записується таким чином:
K2O + СrO3 = K2CrO4.
г) CO2, N2O3 - кислотні оксиди, оскільки це солетворні оксиди неметалів, тоді для них можна запропонувати наступні рівняння реакцій, які доводять їх хімічний характер:
CO2 + Na2O = Na2CO3;
3N2O3 + Al2O3 = 2Al(NO2)3.
Задача 2. Визначити хімічний характер наведених гідроксидів: а) Ba(OH)2, Fe(OH)2; б) Sb(OH)3, H2PbO3; в) HMnO4, HNO2 та довести його за допомогою рівнянь реакцій.
Розв’язання. а) Ba(OH)2, Fe(OH)2 - гідрати основних оксидів BaO i FeO, тому вони є основами. До того ж Ba(OH)2 – розчинна у воді основа - луг. Ці оксиди взаємодіють з речовинами кислотного характеру (кислотами, кислотними оксидами, кислими солями тощо); наприклад:
Ba(OH)2 + H2SO4 = BaSO4¯ + 2H2O;
Fe(OH)2 + Cl2O = Fe(ClO)2 + H2O;
Ba(OH)2 + Ba(HSO4)2 = 2BaSO4¯ + 2H2O;
б) Sb(OH)3, - амфотерний гідроксид - гідрат амфотерного оксиду Sb2O3.. Усі амфотерні гідроксиди погано розчинні у воді (додаток 4) та виявляють двоїсті хімічні властивості: взаємодіючи з кислотами та кислотними оксидами, реагують як оcнoви, а з речовинами основного характеру - виявляють кислотні властивості; наприклад:
Sb(OH)3 + 3HClO3 = Sb(ClO3)3 + 3H2O;
Sb(OH)3  H3SbO3 або Sb2O3 ž H2O = 2HSbO2; H3SbO3 або Sb2O3 ž H2O = 2HSbO2;
2HSbO2 + Na2O = 2NaSbO2 + H2O;
в) HMnO4, HNO2 - кислоти, які є гідратами кислотних оксидів (ангідридів) Mn2O7, N2O3. Кислоти взаємодіють з речовинами основного характеру з утворенням солей; наприклад:
2HMnO4 + K2O = 2KMnO4 + H2O;
HNO2 + ZnO = Zn(NO2)2 + H2O.
Задача 3. Визначити, до якого класу належать наведені хімічні сполуки та навести рівняння реакцій їх одержання: а) KOH, Cu(OH)2; б) H2SO4, H2SiO3; в)Al(OH)3, Sn(OН)2; г) СaSO4; д) NaHSO3, Ca(HCO3)2; е) (CuOH)NO3, (AlOH)SO4
Розв’язання. а) KOH – розчинна у воді основа (луг); луги зазвичай одержують безпосередньою взаємодією основного оксиду з водою:
K2O + H2O = 2KOH
або, взаємодією металу з водою (цей спосіб застосовують тільки для одержання лугів):
2K + 2H2O = 2KOH + H2.
Сu(OH)2 - нерозчинна у воді основа, яку можна одержати за реакцією подвійного обміну - дією лугу на водні розчини, у цьому разі, солей купруму:
СuSO4 + 2KOH = Cu(OH)2¯ + K2SO4;
Сu(NO3)2 + 2NaOH = Cu(OH)2¯ + 2NaNO3.
б) H2SO4 - сульфатна оксигенвмісна кислота, яку можна одержати взаємодією кислотного оксиду з водою:
SO3 + H2O = H2SO4.
H2SiO3 – поганорозчинна оксигенвмісна силікатна (кремнієва) кислота, яку одержують за реакцією подвійного обміну - взаємодією розчинного у воді силікату з сильнішою або менш леткою кислотою (найчастіше сульфатною):
Na2SiO3 + H2SO4 = H2SiO3¯ + Na2SO4.
в) Al(OH)3, Sn(OH)2 - нерозчинні у воді амфотерні гідроксиди, які можна одержати, як і нерозчинні основи, реакцією подвійного обміну між розчинною у воді сiллю металу і розчином лугу:
AlCl3 + 3NaOH = Al(OH)3¯ + 3NaCl.
Якщо розчин лугу буде взято у надлишку, то утворюваний амфотерний гідроксид розчинятиметься, оскільки виявляє кислотні властивості:
Al(OH)3 + 3NaOH = Na3[Al(OH)6].
Амфотерний гідроксид можна одержати також і за реакцією обміну:
Na2SnO2 + H2SO4 = H2SnO2¯ + Na2SO4.
г) СaSO4 - поганорозчинна середня сіль. Найпоширенішими способами одержання середніх солей є реакції кислотно-основної взаємодії; наприклад:
Сa(OH)2 + H2SO4 = СaSO4¯ + 2H2O;
Сa(OH)2 + SO3 = СaSO4 ¯ + H2O;
СaO + H2SO4 = СaSO4¯ + H2O;
СaO + SO3 = СaSO4¯.
Для одержання погaнорозчинних солей також використовують реакції подвійного обміну за участю розчинних у воді речовин; наприклад:
Сa(NO3)2 + Na2SO4 = CaSO4¯ + 2NaNO3
або
Ca(NO3)2 + H2SO4 = CaSO4¯ + 2HNO3.
д) NaHSO4 і Ca(HCO3)2 - кислі солі, продукти неповного заміщення атомів Гідрогену багатоосновних кислот атомами металів. NaHSO4 – натрію гідросульфат; Ca(HCO3)2 - кальцію гідрокарбонат. Загальним способом одержання кислих солей є реакції взаємодії середньої солі з однойменною кислотою (з тією, що має однаковий із сіллю кислотний залишок); наприклад:
Na2SO4 + H2SO4 = 2NaHSO4
або реакції взаємодії солі з іншою кислотою, яку беруть у недостачі:
Na2SO4 + HNO3 = NaHSO4 + NaNO3.
Кислу сіль можна також одержати взаємодією основи з кислотою, якщо взяти надлишкову (порівняно з потрібним для нейтралізації) кількість кислоти:
Сa(OH)2 + 2H2CO3 = Ca(HCO3)2 + 2H2O.
е) (СuOH)NO3, (AlOH)SO4 - основні солі, продукти неповного заміщення гідроксогруп багатокислотних основ кислотними залишками. (СuOH)NO3 –
купруму гідроксонітрат; (AlOH)SO4 - алюмінію гідроксосульфат.
Основні солі зазвичай одержують дією кислоти, яку беруть у недостачі, на основу; наприклад:
Cu(OH)2 + HNO3 = (CuOH)NO3 + H2O
або дією лугу, узятого в недостачі, на середню розчинну сіль:
Al2(SO4)3 + 2NaOH = 2(AlOH)SO4 + Na2SO4.
Під час взаємодії основних солей з кислотами утворюються середні солі; наприклад:
2(AlOH)SO4 + H2SO4 = Al2(SO4)3 + 2H2O,
а під час взаємодії з лугами - основи:
(СuOH)NO3 + NaOH = Cu(OH)2¯ + NaNO3.
Задача 4. За формулами наведених оксидів Al2O3, MnO2, CO2, SeO3, BaO, K2O визначити формули відповідних гідроксидів.
Розв’язання. Гідроксиди кислотних оксидів (CO2, SeO3) - це кислоти; гідроксиди амфотерних оксидів (Al2O3, MnO2) виявляють амфотерні властивості, а гідроксиди основних оксидів (BaO, K2O) - основи. Тому запишемо формули відповідних гідроксидів:
CO2 × H2O = H2CO3 карбонатна (вугільна кислота);
SeO3 × H2O = H2SeO4 селенатна (селенова кислота);
Al2O3 × H2O = H2Al2O4 = 2HAlO2 або Al2O3 × 3H2O = H6Al2O6 = 2H3AlO3 º º 2Al(OH)3 – амфотерний алюмінію гідроксид;
MnO2 × H2O = H2MnO3 або MnO2 × 2H2O = H4MnO4 º Mn(OH)4 – амфотерний мангану (ІV) гідроксид; BaO × H2O = Ba(OH)2 – барію гідроксид (луг);
K2O × H2O = K2O2H2 = 2KOH – калію гідроксид (луг).
Задача 5. Закінчити рівняння реакцій:
а) Na2O + Cl2O7 = в) Ca(HCO3)2 + KOH =
б) NaOH + V2O5 = г) (MgOH)Cl + HNO3 =
Розв’язання. а) Реагуючи між собою, оксиди протилежного хімічного характеру, взаємодіючи між собою, утворюють солі. Щоб визначити кислотний залишок солі, знаходимо формулу відповідної кислоти:
Cl2O7 × H2O = H2Cl2O8 = 2HСlO4 (хлорна кислота).
Отже, рівняння реакцій матиме вигляд:
Na2O + Cl2O7 = 2NaClO4.
б) Оскільки V2O5 - кислотний оксид (метал в оксиді має ступінь окиснення +5), знаходимо формулу відповідної кислоти, щоб визначити кислотний залишок:
V2O5 × H2O = H2V2O6 = 2HVO3,
Тому рівняння хімічної реакції матиме вигляд:
2NaOH + V2O5 = 2NaVO3 + H2O.
в) Кислі солі можуть вступати в реакції солеутворення з речовинами, здатними проявляти основний характер, наприклад:
Ca(HCO3)2 + 2KOH = CaCO3 + K2CO3 + 2H2O.
г) Основні солі зазвичай вступають у реакції солеутворення з речовинами, що мають кислотні властивості, наприклад:
2(MgOH)Cl + 2HNO3 = MgCl2 + Mg(NO3)2 + H2O.
|

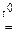 2NaAlO2 + H2O;
2NaAlO2 + H2O; 2Na3AlO3 + 3H2O;
2Na3AlO3 + 3H2O;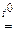 K2SnO3;
K2SnO3; H3SbO3 або Sb2O3 ž H2O = 2HSbO2;
H3SbO3 або Sb2O3 ž H2O = 2HSbO2;