
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
За формулою (9.4) розраховуємо зміну вільної енергії Гіббса у хімічній реакції
|
|
DG0х.р = 2DG0298(HI) - DG0298(I2) - DG0298(Н2);
DG0х.р = 2 × 1, 3 - 0 - 0 = 2, 6 (кДж).
Знаходимо константу рівноваги процесу за стандартних умов:

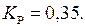
Задача 10. Як зміститься стан рівноваги у реакціях:
а) Н2S  H2 + S, D H 0х.р = 21, 0 кДж, якщо підвищити температуру;
H2 + S, D H 0х.р = 21, 0 кДж, якщо підвищити температуру;
б) FeCl3 + 3KCNS  Fe(CNS)3 + 3KCl, якщо збільшити концентрацію
Fe(CNS)3 + 3KCl, якщо збільшити концентрацію
FeCl3;
в) 2SO2(г) + O2(г)  2SO3(г), якщо підвищити тиск у системі.
2SO3(г), якщо підвищити тиск у системі.
Як впливатиме введення каталізатора на стан хімічної рівноваги цих реакцій?
Розв’язання:
а) Зі зростанням температури збільшаться швидкості і прямої, і зворотної реакцій, але не однаковою мірою. Це пояснюється тим, що вони мають різні температурні коефіцієнти швидкості реакції. Згідно з принципом Ле Шательє, зростання температури зміщує рівновагу в напрямі ендотермічної реакції, тобто у напрямі того процесу, внаслідок якого теплота буде поглинатися.
Оскільки подана реакція ендотермічна (D Н 0х.р > 0), підвищення температури змістить рівновагу в бік прямої реакції;
б) Збільшення концентрації однієї з реагуючих речовин зміщує рівновагу в бік тієї реакції, під час проходження якої ця речовина витрачається. Для заданого процесу збільшення концентрації вихідної речовини FeCl3 змістить рівновагу в напрямі прямої реакції;
в) Підвищення тиску зміщує хімічну рівновагу в бік реакції, де тиск системи зменшується, тобто реакція проходить зі зменшенням кількості молів газів.
Для реакції 2SO2(г) + O2(г)  2SO3(г) підвищення тиску в системі зміщує рівновагу в бік прямої реакції, оскільки кількість газоподібних продуктів реакції (2 моль SO3) менша, ніж кількість газоподібних вихідних речовин (2 моль SO2 та 1 моль O2).
2SO3(г) підвищення тиску в системі зміщує рівновагу в бік прямої реакції, оскільки кількість газоподібних продуктів реакції (2 моль SO3) менша, ніж кількість газоподібних вихідних речовин (2 моль SO2 та 1 моль O2).
Введення каталізатора сприяє прискоренню прямої та зворотної реакцій однаковою мірою, тому каталізатор не зміщує стан хімічної рівноваги, а тільки прискорює момент його досягнення.