
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
МОДУЛЬ №4 1 страница
|
|
«Обмін речовин. Біохімічні процеси при зберіганні сировини для бродильного виробництва»
Лекція 12
Обмін речовин
[ 1.с. 221-242; 2. с. 322-347; 4. с. 148-156 ]
План
1. Загальні уявлення про обмін речовин і енергії.
2. Біологічне окиснення.
3. Енергетичний баланс організму. Макроергічні сполуки.
1. ЗАГАЛЬНІ УЯВЛЕННЯ ПРО ОБМІН РЕЧОВИН І ЕНЕРГІЇ.
Обмін речовин і енергіі є однією з найважливіших ознак живого організму.
Живі організми – відкриті системи, для існування яких необхідний постійний двосторонній зв’язок (обмін) з навколишнім середовищем. З навколишнього середовища вони одержують поживні речовини та енергію, перетворюють їх, видозінюють, використовуючи утворені сполуки для власних потреб, та повертають в навколишнє середовище кінцеві продукти обміну. Вся сукупність процесів поглинання, засвоєння речовин з навколишнього середовища та утворення і виділення кінцевих продуктів – суть обміну речовин.
Розглядаючи життя як вищу форму руху живої матерії, як спосіб існування біополімерних тіл та систем, здатних до самооновлювання і самовідтворення в умовах постійного взаємозв’язку з навколишнім середовищем, незаперечним є те, що обмін речовин є основою всіх проявів життєдіяльності. Припинення обміну речовин рівнозначне припиненню життя. Обмін речовин відбувається в неживій природі, однак цей процес значно відрізняється від обміну в живих системах. Ця відмінність зумовлена насамперед тим, що обмін речовин у живих організмах забезпечує постійне самооновлення та самовідтворення його складових частин і здійснюється завдяки злагодженій дії численних систем та специфічних факторів, що забезпечують процеси життєдіяльності. У нежівй природі обмін відбувається в одному напрямі, що призводить до видозміни, а часто і руйнування неживих тіл. Обмін речовин в живих організмах має багато суттєвх ознак.
Насампереред для обміну речовин у живих організмах характерним є скоординованість біохімічних перетворень у просторі і часі, завдяки чому рівні процеси, інколи прямо протилежні, здійснюються одночасно, не заважаючи один одному. Це значною мірою забезпечується за рахунок кампартменізації - окремі біохімічні перетворення відбуваються на певних ділянках клітин чи в специфічних органелах клітин. Досить важливим є і те, що перебіг процесів проходить у суворо визначеній послідовності, при цьому кожна попередня реація створює умови для здійснення наступної. В цьому важлива роль належить біологічним каталізаторам – ферментам, які мають багато спеціфних властивостей і забезпечують складні біохімічні перетворення численних субстратів та спряженість цих перетворень на метаболізму та енергктичному рівнях. Це створює умови для забезпечення саморегуляції та підтримання гомеостазу – необхідної умови існування живих організмів.
Умовно обмін речовин поділяють на загальний, проміжний та внутрішньоклітинний. Загальний обмін включає процеси надходження поживних речовин в організм, їх перетворення і виділення продуктів обміну.
Проміжний обмін – це перетворення речовин в організмі з моменту надходження кінцевих продуктів обміну. Внутрішньоклітинний обмін – це перетворення речовин після всмоктування.
Обмін речовин складається з фізіологічних (травлення, всмоктування, виділення) і фізичних (сорбція, дифузія, осмос), хімічних (окиснення, відновлення, гідроліз, фосфороліз) процесів, які здійснюються при проміжному та внутрішньому обміні.
Реакції розщеплення характеризуються протилежним процесом – розщеплення складних сполук з утворенням простіших. Це так звані катаболічні реакції, тобто обмін речовин можна розглядати як діалектичну єдність двох протилежних і взаємопов’язаних процесів – розщеплення і синтезу – асиміляції і дисиміляції.
Асиміляція – це частина загального обміну, що супроводжується поглинанням органічних сполук з навколишнього середовища, засвоєнням, перетворенням та синтезом за їх рахунок різних структур організму.
Дисиміляція – це частина загального обміну, в процесі якого відбувається руйнування та розщеплення складних органічних сполук, які потрапляють з продуктами харчування, та тих, що входять до складу власних структур організму – білків, вуглеводів, ліпідів з утворенням простіших сполук та кінцевих продуктів обміну.
2. БІОЛОГІЧНЕ ОКИСНЕННЯ.
При диханні, як і при згоранні, відбувається поглинання кисню та утворення СО2 і Н2О. Енергетичний ефект окиснення органічних сполук в організмі та згоряння їх також виявились тотожними. Так, при окисненні глюкози до кінцевих продуктів і при згорянні її в колориметрі виділяється однакова кількість енергії 2881 кДЖ/моль.
Перші спроби з’ясувати особливості та механізм окиснення сполук в організмі (біологічного окиснення) зробив Ф. Шенбайн, який висловив припущення, що біологічне окиснення – це каталітичний процес, необхідною умовою перебігу якого є активація кисню. Активування кисню здійснюється за рахунок енергії сполук, здатних до самоокиснення, та ферментів оксидаз. Такими сполуками є каротин, терпени, Полєнові вищі жирні кислоти, в молекулах яких є краплі подвійні зв’язки, внаслідок чого вони легко взаємодіють з молекулярним киснем, утворюючи пероксидні сполуки, які розщеплюються за участю ферментів пероксидаз і утворюють активний кисень. Останній окислює молекули інших органічних сполук, які з молекулярним киснем не реагують:

Оскільки окиснення проходить через утворення пероксидних сполук, то теорія О. М. Баха дістала назву пероксидної теорії окиснення.
3. ЕНЕРГЕТИЧНИЙ БАЛАНС ОРГАНІЗМУ. МАКРОЕРГІЧНІ СПОЛУКИ.
 Обмін речовин в організмі тісно пов'язаний з обміном енергії. Постійне надходження та використання енергії є необхідною умовою існування живих організмів як відкритих систем. За рахунок надходження енергії забезпечується підтримання стабільного, впорядкованого стану живої системи, що запобігає дезорганізації, хаосу та її загибелі. Енергія необхідна організму для забезпечення таких процесів: виконання різної роботи (механічної, осмотичної, фізичної); руху, скорочення та розслаблення м’язів; синтезу та розщеплення різних сполук; транспорту речовин та іонів; гомеостазу; виконання специфічних функцій, що забезпечують процеси життядіяльності.
Обмін речовин в організмі тісно пов'язаний з обміном енергії. Постійне надходження та використання енергії є необхідною умовою існування живих організмів як відкритих систем. За рахунок надходження енергії забезпечується підтримання стабільного, впорядкованого стану живої системи, що запобігає дезорганізації, хаосу та її загибелі. Енергія необхідна організму для забезпечення таких процесів: виконання різної роботи (механічної, осмотичної, фізичної); руху, скорочення та розслаблення м’язів; синтезу та розщеплення різних сполук; транспорту речовин та іонів; гомеостазу; виконання специфічних функцій, що забезпечують процеси життядіяльності.
У процесі еволюції в живих організмах сформувались механізми, які забезпечують сприймання або вилучення енергії, генерацію, акумулювання її та використання організмом. Різні форми енергії, що існують у живих системах – хімічна, електрична, світлова, теплова, можуть взаємоперетворюватись одна в одну.
Залежно від способу вилучення енергії всі живі організми поділяють на фото- і хемотрофи. Фототрофи у вигляді джерела енергії використовують енергію квантів світла. До фототрофів належать зелені організми, водорості, деякі бактерії. Дані організми синтезують складні органічні сполуки з неорганічних (СО2 і Н2О) за рахунок енергії сонячного випромінювання, тобто вони здатні до сприймання і перетворення енергії електромагнітних коливань потоку сонячного випромінювання на енергію хімічних зв’язків органічних сполук. За типом живлення дані організми належать до аутотрофних. Хемотрофні організми у вигляді джерела енергії використовують енергію окиснення органічних сполук чи неорганічних сполук. У першому випадку їх відносять до органотрофів, а в другому – до літотрофів. За типом живлення хемотрофні організми є гетеротрофами.
Гетеротрофи не можутьсинтезувати складні органічні сполуки з неорганічних і використовувати їх в готовому вигляді. До гетеротрофів належать організми людини, тварини та деякі мікроорганізми.
Під час перетворення зв’язків рівень загальної потенціальної енергії змінюється. При цьому енергія, що міститься в хімічних зв’язках, розсіюється у вигляді теплоти частково, тобто вивільнення енергії проходить не одномоментно, а поступово і частина її використовується для виконання роботи. В зв’язку з цим у клітині різних температурних змін не спостерігається. Зміна ентальпії (∆ Н) при розриві хімічних зв’язків має такий вираз:
∆ H=∆ F+ρ ∆ V,
де ∆ F- зміна загальної енергії системи; ρ - тиск; ∆ V- зміна об’єму.
Оскільки в біологічних системах зміною об’єму можна знехтувати, то ∆ H≈ ∆ F.
Зміну вільної енергії системи можна визначити як ту частину зміни загальної енергії, яка може бути використана для виконання роботи системою, що прагне до рівноваги за нормальних умов. Так, зміна вільної енергії в ході реакції А→ В дорівнює
∆ G◦ =∆ H-Т∆ S,
звідси ∆ H=∆ G◦ + Т∆ S, де ∆ G◦ - зміна стандартної вільної енергії системи; ∆ H- зміна загальної енергії системи; Т- абсолютна температура; ∆ S- зміна енергїї.
Ентропія – це частина загальної системи, яка не використовується для виконання роботи і розсіюється у вигляді теплоти. При будь-якому перетворенні енергії значення енропії збільшується.
В організмі існує тісний взаємозв’язок між процесами звільнення та використання енергії. Основна маса енергії, акумульованої в хімічних зв’язках органічних сполук, виділяється при катаболізмі на другому і третьому етапах (анаеробне та аеробне окиснення). Однак виділена енергія не використовується безпосередньо для потреб організму, а попередньо перетворюється на доступну форму. Такою універсальною сполукою є АТФ, яка може бути в ролі донора, акцептора та трансформатора енергії. Однак енергія окиснення органічних сполук на АТФ не передається, оскільки в клітині безпосередня передача енергії від низько- до високоенергетичних сполук не відбувається. Цей процес здійснюється за участю посередників- макроергічних сполук, які утворюються під час окиснення субстратів, і нагромаджують енергію окиснення в макроергічних зв’язках.
Макроергічні зв’язки - це зв’яки, при перетворенні яких рівень зміни вільної енергії становлять понад 20 кДЖ/моль. Макроергічні зв’язки позначають знаком тільда~. Якщо при перетворенні зв’язків рівень зміни вільної енергії становить 12-20 кДЖ/моль, такі сполуки є нормальними в енергетичному відношенні.
Макроергічні сполуки, як правило, містять фосфорну групу в α - положенні, яка при розриві макроергічного зв’язку може переноситись на інші сполуки у вигляді – активного фосфорилу:

Лекція 13
Обмін білків
[ 1.с. 320-337; 2. с. 347-389; 4. с. 286-327 ]
План
1. Перетворення білків в травному каналі.
2. Обмін білків і амінокислот в тканинах.
3. Перетворення амінокислот. Біосинтез білків.
1. ПЕРЕТВОРЕННЯ БІЛКІВ В ТРАВНОМУ КАНАЛІ.
Білки з їжі надходять до тканин організму лише після їх розщеплення до сполук, які позбавлені видової і тканинної специфічності. Такими сполуками є амінокислоти і, очевидно, окремі пептиди.
Розщеплення білків, що входять до складу їжі, починається в шлунку і закінчується в тонкій кишці. У ротовій порожнині білки не піддаються змінам, оскільки в слині відсутні протеолітичні ферменти.
У шлунку на білки діють соляна кислота і протеолітичний фермент шлункового соку – пепсин. У молочних тварин і дітей шлунковий сік містить ще один фермент – хімозин (ренін, сичуговий фермент)
Соляна кислота, що виділяється обкладними клітинами шлунка, забезпечує необхідну кислотність для каталітичної дії ферментів. Так, у людини рН шлункового соку дорівнює 1, 5 – 2, 5. У різних видів сільськогосподарських тварин кислотність шлункового соку коливається в межах 1, 1 – 5, 6 (у свиней 1, 1 – 2, 0, у великої рогатої худоби – 2, 2 – 3, 1, в овець 1, 9 – 5.6 і т. д). Разом з цим соляна кислота каталізує процеси перетворення пепсину на пепсин, набухання і розпушування білків, що, в свою чергу, полегшує каталітичну дію ферментів, а також запобігає розвитку і шлунку гниття та бродіння. Шлунковий сік містить 0, 4 – 0, 5 % вільної сольної кислоти.
Пепсин утворюється в головних клітинах залоз слизової оболонки шлунка в неактивній формі, тобто у вигляді проферменту – пепсиногену. Пепсин є білком – фосфопротеїдом, який має висок каталітичну активність – 1г кристалічного ферменту за 2 год може розщепити 50 кг денатурованого яєчного альбуміну. В 1 мг шлункого соку міститься близько 1 мг пепсину. Якщо взяти до уваги, що протягом доби в організмі людини утворюється до 2 л шлункого соку, можна зробити висновок, що головні клітини залоз слизової оболонки шлунка щодобово утворюють і виділяють 2 г пепсину. Отже, перетравлю вальна активність шлункового соку щодо білкових речовин досить висока.
Пепсин діє на нативні і денатуровані білки. З високою швидкістю проходить гідролітичне розщеплення пептидних зв’язків, утворених за участю таких циклічних амінокислот, як фенілаланін і тирозин, а також пептидних зв’язків між лейцином і глютаміновою кислотою або валіном.
Під дією пепсину відбувається гідролітичне розщеплення здебільшого внутрішніх пептидних зв’язків білка. Це підтверджується тим серед продуктів розщеплення виявлено поліпептиди, які складаються з 4 – 10 і більше залишків амінокислот. Вільних амінокислот утворюється дуже незначна кількість.
Продукти гідролізу білка іноді називають альбумозами або просто пептидами. У шлунках дітей і молодих тварин, як уже зазначають, міститься фермент хімозин, який специфічно діє на основний білок молока – казеїн хімозин, який специфічно діє на основний білок молока – казеїн, перетворюючи його на казеїн.
Окремі амінокислоти, які не всмоктались у тонкій кишці, та деякі білки, що не розщепились, потрапляють у товсту кишку, де за участю мікроорганізмів піддаються різним перетворенням. Цей процес дістав назву гниття білків. У процесі перетворення з амінокислот утворюються аміни, жирні кислоти, феноли, індол, скатол та інші сполуки, частина з яких є отруйними для організму.
Так, під час декарбоксилювання діаміномонокарбонових кислот орнітину і лізину утворюються відповідно путресцин і кадаверин:

Ці аміни є отруйними кислотами. Вони належать до трупних отрут.
2.ОБМІН БІЛКІВ І АМІНОКИСЛОТ В ТКАНИНАХ.
В організмі постійно відбувається розщеплення і синтез білків. Обмін білків здійснюється досить інтенсивно. Так, введенням мічених атомів в організм доведено, що вони з високою швидкістю проникають у білки тканин. Однак швидкість оновлення білків різних тканин не однакова, хоч і досить висока.
Інтенсивно проходить обмін білків у печінці. В цьому органі він інтенсивніший, ніж в інших органах, і поступається лише підшлунковій залозі.
Так, в організмі людини білки печінки оновлюються за 10-12 діб, а білки плазми лише за 20-40 діб. Оновлення всіх білків в організмі людини відбувається за 135-155 діб, тобто протягом цього часу всі білкові компоненти людського організму повністю оновлюються шляхом розщеплення і синтезу.
Основним шляхом розщеплення білків є їх гідролітичне розщеплення до амінокислот. Цей процес протікає не тільки в травному каналі, а й у кожній клітині організму. Гідроліз білків у клітинах різних тканин відбувається в субклітинних утвореннях – лізосомах - під впливом пептидаз, які дістали назву катепсинів.
Нещодавно виявлено ще один шлях розщеплення білків у тканинах за участю нуклеозидтрифосфатів, зокрема АТФ. За цих умов утворюються нуклеотидпептид і поліпептид, укорочений на певну кількість залишків амінокислот:

У процесі обміну в організмі постійно міститься певна кількість амінокислот. Вони утворюються внаслідок надходження амінокислот з білками їжі, амінокислот, що синтезуються з інших органічних сполук, а також внаслідок розщеплення білків різних органів і білків і ряду інших біологічно важливих речовин. Інша частина піддається різним хімічним перетворенням.
3.ПЕРЕТВОРЕННЯ АМІНОКИСЛОТ. БІОСИНТЕЗ БІЛКІВ.
В основі перетворення амінокислот лежать три основні види реакцій: реакції з аміногрупою, за карбоксильною групою і за радикалом амінокислот. Перші два види реакцій однотипні для всіх L- амінокислот. Реакції амінокислот за радикалом досить різноманітні і специфічні майже для кожної амінокислоти.
Перетворення амінокислот за аміногрупою. До таких реакцій належать два основні види перетворення амінокислот: дезамінування, і переамінування.
Дезамінування – процес відщеплення аміногрупи від амінокислоти з утворенням молекули аміаку. Відомо чотири види дезамінування: окислювальне, відновлювальне, гідролітичне і внутрішньомолекулярне.
Під час окислювального дезамінування амінокислоти перетворюються на кетокислоти:

Перетворення амінокислоти за карбоксильною групою. До таких реакцій належать реакції декарбоксилювання амінокислот з утворенням аміноациладенілатів.
Процес декарбоксилування амінокислот досить поширений як у тваринних, так і в рослинних організмах. Він пов’язаний з відщепленням від молекули амінокислоти СО2 за рахунок карбоксильної групи, в результаті чого утворюються відповідні аміни:

Перетворення амінокислот за радикалами. Для амінокислот, крім реакцій за аміно – та карбоксильною групами, властиві хімічні перетворення, пов’язані з реакціями за радикалом.
Характерною особливістю радикалів амінокислот є те, що вони містять рівні функціональні групи, рухомі атоми водню тощо. Цим зумовлена активна участь їх в багатьох хімічних реакціях, частина з яких приводить до утворення ряду замінних амінокислот в організмі. Під час окиснення радикала амінокислоти фенілаланіну утворюється амінокислота тирозин:
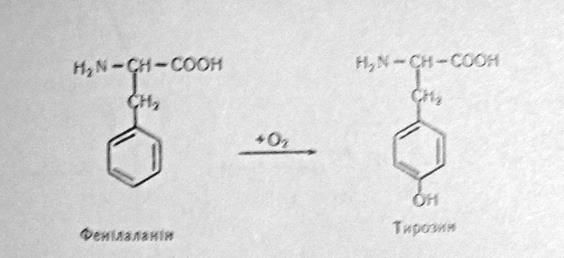
Реакцію каталізує фермент фенілаланін – гідроксилаза.
Кінцеві продукти обміну амінокислот. Підсумовуючи перетворення амінокислот за аміно- і карбоксильною групами та за радикалами, слід зазначити, що за цих самих умов утворюються аміак, оксид вуглецю (IV), карбоксильні кислоти, кетокислоти, аміни та інші сполуки. Якщо ці сполуки не використовуються в процесах синтезу, то вони піддаються дальшим перетворенням (крім NH3 і CO2). Аміни внаслідок окислювального дезамінування перетворюються на карбонові кислоти, карбонові кислоти і кетокислоти. які утворились внаслідок розщеплення амінокислот, піддаються β - окисненню і в трикарбоновому циклі розщеплюються до кінцевих продуктів – Н2О і CO2, Отже кінцевими продуктами розщеплення амінокислот є аміак, вода і оксид вуглецю (IV).
Аміак, що утворюється під час обміну амінокислот у низькоорганізованих організмів, в яких продукти обміну виділяються в порожнину тіла і вимиваються водою, є кінцевим продуктом білкового обміну. Він може виділятись як кінцевий продукт азотистого обміну й у вигляді солей амонію. Такі організми дістали назву амоніотелітичних. До них належать краби, річкові раки, п’явки, каракатиці і деякі інші. Для організмів людини високоорганізованих тварин аміак є токсичною речовиною. Особливо шкідливо він впливає на центральну нервову систему, значно порушує процеси тканинного дихання. Тому аміак в процесі утворення відразу ж зв’язується з утворенням нетоксичних для організму сполук. Одним з важливих методів знешкодження аміаку є взаємодія його з аспарагіновою і глютаміновою кислотами:

Аміак у складі аспарагіну і глютаміну надходить у печінку, де з нього синтезується сечовина, що є кінцевим продуктом обміну білків і амінокислот у більшості хребетних. Такі організми дістали назву уреотелітичних. До них належать ссавці, амфібії, деякі риби, черепахи та інші.
Слід зауважити, що є ряд факторів, які свідчать про використання сечовини в організмах тварин. Однак це властиве лише для жуйних тварин, які мають багатокамерний шлунок, що містить величезну кількість мікроорганізмів. У рубці карбамід розщеплюється ферментом уреазою, Який виділяється мікроорганізмами, до аміаку й оксиду вуглецю (IV). З аміаку і продуктів розщеплення вуглеводів корму мікроорганізми синтезують білок свого тіла, який надходить у сичуг і кишки, де перетравлюється і засвоюється організмом тварини. Саме ця особливість зумовлює широке використання сечовини як часткового замінника білка в раціоні жуйних тварин.
БІОСИНТЕЗ БІЛКІВ.
Відомо, що в організм людини і тварин синтезується мільйони різних білків. Вони відрізняються один від одного, насамперед, хімічною природою та послідовністю розташування залишків амінокислот у поліпептидних ланцюгах, тобто первинною структурою. Інформація про те, яким повинен бути білок, закладена в ДНК у вигляді певної послідовності нуклеотидних залишків у полінуклеотидному ланцюгу. Оскільки ДНК знаходиться в ядрі, а біосинтез відбувається на рибосомах, то ДНК передає інформацію щодо процесу синтезу білка через іРНК, яка синтезується на певній ділянці (гені) одного з нуклеотидних ланцюгів ДНК.
В основі передачі інформації лежить принцип комплементарності. У синтезованій іРНК послідовність нуклеотидів відповідає послідовності нуклеотидів в одному з полінуклеотидних ланцюгів ДНК. Відмінність полягає лише в тому, що замість тимідинового нуклеотиду в іРНК міститься уридиновий нуклеотид. Процес копіювання даної інформації з ДНК на іРНК називається транскрипцією.
Процес передачі інформації з іРНК, яка закодована в певній послідовності нуклеотидів в її молекулі, на процес розщеплення залишків амінокислот у білкових молекулах називається трансляцією.
Отже передачу інформації від ДНК на синтез білка можна подати схемою:

Процес сполучення амінокислот із «своїми» тРНК за участю ферменту аміноацил – тРНК – синтетази називають рекогніцією
Лекція 14
Біохімічне перетворення білків у технологічноу процесі
[ 1.с. 66-72; 2. с. 81-83; ]
План
1. Денатурація білків
2. Розпад та перетворення амінокислот
3. Температурна обробка білків
4. Вплив інших факторів на структуру білків
1. Денатурація білків
Будь-яка зміна умов середовища в технологічному процесі виробництва харчових продуктів впливає на не ковалентні зв’язки молекулярної структури і призводить до порушення четвертинної, третинної і вторинної структури білка. Порушення нативної структури призводить до втрати біологічної активності (ферментативної, гормональної) і називається денатурацією білка. Це відбувається без зміни первинної структури.
Більшість білків денатурують у присутності кислот, лугів, нагріванні і охолодженні, обробці ПАР, важкими металами(Ag, Pb, Hg), органічними розчинниками (етанол, метанол, ацетон). Ця властивість білків застосовується для їх виділення з харчової сировини, а фактори, які впливають на денатурацію (присутність інших речовин) використовуються для підвищення або зниження активності ферментів.
Більшість білків денатурує при 60-80°С, але є і такі: ферменти термофільних мікроорганізмів, лактоглобулін молока. Така властивість термостійких білків пояснюється наявністю в молекулі великої кількості дисульфід них зв’язків. Теплова денатурація білка – основний процес, що відбувається у процесі випікання хліба, печива, бісквітів, сушіння макаронних виробів, одержання сухих сніданків, варіння і смаження овочів, риби, м’яса, стерилізації молока і т.д.
Цей процес прискорює травлення білків у шлунково-кишковому тракті, так як полегшує доступ до них ферментів і обумовлює органолептичні і споживчі властивості харчових продуктів, наприклад пористу структуру хліба і м’якість м’яса.
Але ступінь денатурації може бути різною – до повного порушення структури і утворення нових пептидних і дисульфідних зв’язків. Засвоєння таких полімерів погіршується. Так, переварене яйце, пересмажене м’ясо засвоюються гірше.
2. Розпад та перетворення амінокислот
Продукти гідролітичного розпаду білків – амінокислоти є джерелом живлення мікроорганізмів. Токсичні продукти можуть утворюватися при мікробному псуванні білкових продуктів. Розщеплення білків і їх похідних, викликане мікроорганізмами одержало назву гниття.
Найчастіше розпад амінокислот йде шляхом окислювального дезамінування, в результаті утворюються аміак і α -кетокислоти.

Потім амінокислота приєднуючи воду розпадається на кетокислоту і аміак:

Також гідролітичне дезамінування  утворює оксикислоти, а відновлення
утворює оксикислоти, а відновлення  - жирні кислоти. При розкладі амінокислот по схемі так званого внутрішньо-молекулярного дезамінування утворюються ненасичені жирні кислоти і аміак:
- жирні кислоти. При розкладі амінокислот по схемі так званого внутрішньо-молекулярного дезамінування утворюються ненасичені жирні кислоти і аміак:

Деякі кетокислоти і оксикислоти можуть надалі перетворюватись, при каталітичній дії декарбоксилаз в альдегіди і вуглекислий газ:

а оксикислоти у спирти і вуглекислий газ:

У більшій кількості утворюються оцтова і масляна, а потім мурашина і пропіонова кислота, які надають продуктам неприємний запах.
Розповсюдженим процесом розпаду амінокислот під дією декарбоксилаз мікроорганізмів, являється утворення вуглекислого газу і відповідного аміну. З гістидину утворюється гістамін, з тирозину – тирамін, з лізину – кадаверін, з орнітину – путресцин, які мають сильну фармакологічну дію.
Інші бактеріальні ферменти викликають специфічні перетворення ряду амінокислот. Так, при розпаді триптофану утворюється індол і скатол, постуаово руйнується боковий ланцюг, залишаючи цілою кільцеву структуру.


Специфічні перетворення тіоамінокислот під дією ферментів мікроорганізмів ведуть до утворення сірководню і меркаптанів.

Індол, скатол, крезол, сірководень і меркаптан – отруйні і з неприємним запахом речовини.
3. Температурна обробка білків
Притемпературі від 50 до 100°С відбувається реакція взаємодії білків з відновлюючими цукрами з утворенням темнозабарвлених продуктів – меланоїдинів.
Теплова обробка білковмісних продуктів при 100-120°С призводить до деструкції молекул білка, розриву пептидних зв’язків, відщеплення функціональних груп, утворення 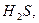

 і багатьох шкідливих небілкових сполук.
і багатьох шкідливих небілкових сполук.
Так, стерилізація молочних, м’ясних, рибних продуктів при температурі 115°С призводить до розпаду цистеїнових залишків з утворенням сірководню, диметилсульфіду 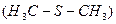 і цистеїнової кислоти
і цистеїнової кислоти 
Реакції дезамінування аспарагінової і глутамінової кислот та дегідратації гліцину можуть бути причиною утворення нових ковалентних зв’язків:

Серед продуктів термічного розпаду білків зустрічаються мутагенні сполуки. Вони містяться в бульйонах, смаженому м’ясі, яйцях, копченостях, в’яленій рибі. Ці сполуки викликають спадкові зміни в ДНК, що може мати різні непередбачувані наслідки.
В екстрактах, виділених із смажених риби і м’яса, бульйонів знайдені продукти піролізу амінокислот та інші продукти ізомеризації та конденсації амінокислот.

Утворення токсичних сполук відбувається при тепловій обробці білкових пробуктів з температурою вище 200°С, а також при нижчих температурах у лужному середовищі, яке використовується при одержанні ізолятів і концентратів білків. Зміни також зумовлені реакціями ізомеризації залишків амінокислот з L- у D-форму, що знижує біологічну цінність продукту на 50%.