
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Властивості Мангану, Ренію та їхніх сполук
|
|
Дослід 1. Мангану (II) гідроксид та його властивості.
1. У дві пробірки внести по 3-4 краплини розчину солі Мангану (II) і по 2-3 краплини розчину лугу. Що спостерігається? Перемішати одержаний осад гідроксиду скляною паличкою і спостерігати побуріння осаду внаслідок окиснення Mn(II) у Mn(I 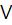 ) під дією кисню повітря. Скласти рівняння реакцій добування і окиснення гідроксиду Mn(II). Перевірити властивості манган (II) гідроксиду на амфотерність, додавши до осаду гідроксиду мангану (II) луг та кислоту.
) під дією кисню повітря. Скласти рівняння реакцій добування і окиснення гідроксиду Mn(II). Перевірити властивості манган (II) гідроксиду на амфотерність, додавши до осаду гідроксиду мангану (II) луг та кислоту.
Дослід 2. Окисно-відновні властивості сполук мангану (IV).
1. У пробірку покласти кілька кристаликів MnO2 і додати 2-3 краплини хлоридної кислоти (ρ =1.19г/см3). Який газ і якого кольору виділяється? Скласти рівняння реакції. Яку роль відіграє в даному окисно-відновному процесі MnO2 ?
2. У тигель внести по невеликому шматочку кристалів NaOH та KNO3. Тигель поставити на азбестову сітку або фарфоровий трикутник і нагріти до плавлення суміші. До розплаву, що ще не встиг захолонути, додати кілька кристалів діоксину Mn і нагрівати доти, доки не з'явиться зелене забарвлення, а маса не загустіє. Сплав, що охолонув зберегти для подальших дослідів. Записати рівняння реакції окиснення MnO2 до KMnO4 . Чим є MnO2 у цій реакції окисником чи відновником?
Дослід 2. Окисно-відновні властивості сполук Мангану (VI).
1. Розплав K2 MnO4 розчинити в невеликій кількості води (1\2 його об'єму). Одержаний розчин піпеткою перенести у три пробірки по 5-6 краплин в кожну. У першій пробірці спостерігати процес диспропорціювання K2MnO4 на MnO2 та KMnO4 з утворенням KOH.
2. У другу пробірку додати 2-3 краплини хлорної води (сіжоприготовленої). Звернути увагу на утворення рожевого забарвлення. Окисником чи відновником є сполука Mn(VI) у цій реакції?
У третю пробірку до розчину манганату додати кристалічний натрію сульфіт (1-2 мікрошпателя). Спостерігати знебарвлення розчину. Які властивості окисника чи відновника виявляє в даному випадку сполука Mn(VI).
Дослід 3. Окисні властивості сполук Мангану (VII).
1. У пробірку внести по 3-4 краплини розчину KMnO4 . У першу з них додати 2 краплини 2 н розчину H2SO4 , у другу – стільки само води, у третю - розчин NaOH. У всі пробірки додати по мікрошпателю сульфіту натрію. Що спостерігається? Записати рівняння реакцій. Як впливає рН на окисні властивості KMnO4 ?
2. У пробірку внести 3-4 краплини розчину калію перманганату і такий же об'єм розчину манган (II) сульфату. Спостерігати утворення бурого осаду та зникнення фіолетового забарвлення. За допомогою синього лакмусового папірця визначити, яке середовище у розчині. Скласти рівняння реакції, внаслідок якої утворюється манган діоксид та калій сульфат.
3. У пробірку внести 3-5 краплин розчину калій перманганату 2-3 краплини сульфатної кислоти (2 н) та 3-4 краплини 10 %-го розчину гідроген пероксиду. Спостерігати виділення бульбашок кисню. Скласти рівняння реакції.
Завдання та запитання для самопідготовки
1. Записати електронні формули Mn, Te, Re.
2. Вказати різницю в будові атомів елементів підгрупи Мангану і галогенів. В якому ступені окиснення сполуки цих елементів найбільш подібні?
3. В яких кислотах розчиняється Манган? Реній? Записати рівняння відповідних реакцій.
4. Записати формули всіх ідомих оксидів Мангану; як їх отримати? Які кислотно- осноні та окисно-відновні властивості вони мають? (навести рівняння реакцій внаслідок кожного з цих оксидів з хлоридною, нітратною та сульфатною (концентрованими) кислотами на холоду та при нагріванні, а також з лугами).
5. Які ступені окиснення характерні для Мангану в кислому, нейтральному та лужному середовищах?
6. Записати поведінку сполук Мангану (II, III, IV) під дією сильних окисників в лужному (кислому) середовищі, а сполук Мангану (IV, VII) в нейтральному, лужному, кислому середовищах під дією відновників (відновники та окисники взяти з розділу " Окисно-відновні реакції").
7. Закінчити рівняння реакцій
KMnO4 +K2SO3+H2O→ MnO2+H2SO4(конц)→
KMnO4 +C2H5OH + H2SO4 → MnSO4 +PbO2 +HNO3→
K2MnO4+ H2SO4 → Re2S7+ (NH4)2 S→
KMnO4+H2O2+ H2SO4→ HReO4+Zn+KOH→
KMnO4 + (NH4)2 S+H2O→ MnO2+KClO3 +KOH→
KMnO4+Al+ H2SO4 → KMnO4(нагрівання) →
KMnO4 +Na2SO3 +KOH→ Re2S7+HNO3(конц)→
MnO2(500oC)→ MnO+O2(300оС)→
Mn(OH)2+O2+H2O→ Mn2O3(950оС)→
Re+HNO3→ ReSO4+HNO3→
Mn3O4+ HCl→ KMnO4+HJ→
MnO2+HCl→ Mn3O4+Al→
MnO2+ KNO3+KOH→ KMnO4+Na2S+H2SO4→