Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Водорастворимые витамины и их ф-и. Витаминоподобные в-ва. Микроэлементы.
|
|
Большинство водораствор.витаминов не накапливаются в организме, поэтому должны поступать ежедневно. Вит С- Аскорбиновая к-та- белое крисстал. В-во кислого вкуса, без запаха, легко окисляется и растворяется в H2O. В кислой среде витамин С сохраняется лучше. Повышает устойчивость организма к инфекциям, укрепляет стенки сосудов, участвует в реакциях гидроксилирования, необходим для синтеза кортикостероидов и для образования нейромедиаторов. (черная смородина, шиповник, картофель, грецкий орех, цитрусовые). Вит.В1 - Тиамин- в чист.виде-бесцвет кристаллы с запахом дрожжей, хорошо растворимы в H2O.Отвечает за углевод.
обмен, регулирует ф-и эндокрин, централ, периферич. систем. Необходим для передачи нерв. Импульса. (дрожжи, хлеб грубого помола, кукуруза, фасоль). Вит В2 - рибофлавин- в чистом виде оранжево-желтый порошок горького вкуса, трудно растворим в H2O, окисляет восстановленную форму НАД•Н, окисляет жирные к-ты. (сыр, молоч продукты) Вит В3- Пантотеновая кислота- в чист. Виде- жидкость желтого цвета, хорошо растворима в H2O. Отвечает за энергетич.обмен, ф-и нерв. Сист и перестатику кишечника, осабляет побочное дейстивие антибиотиков. (печень, яйца, дрожжи). Вит В6- пиридоксин- бесцвет. Кристаллы, хорошо растворимые в H2O, участвует в обмене БЖУ, необходим для усвоения аминокислот, участв в образ. гемоглобина. (печень, дрожжи, рис, горох). ВитВ9, В10, Вс (фолиевая кислота) - в чистом виде- кристаллы оранжево-желтые, плохо раствор в H2O. Необходим для роста и развития, регулир уровень гемоглобина, оказывает обезболивающ. действие. Недостаток при беременности. (капуста, петрушка, бобы, в листьях раст). Вит В12- цианкобаламин - красное кристаллич. В-во, без вкуса и запаха, на свету разлагается. Необходим для норм кроветворения, нормализует жиров обмен в печени, снижает уровень холестерина в крови, улучшает память, участвует в транспорте водорода и в синтезе метионина. (говяжья печень, сердце, молоко). Вит РР- никотиновая к-та, никотинамид - белые кристаллы без запаха, устойчив при кипячении, кисловатого вкуса. Влияет на обмен белков и холестерина, расширяет мелкие сосуды, поддержив работу сердца, желудка, кишечника, используется для синтеза НАД и НАДФ. (морская рыба, грибы, соя, пшенич.отруби) Витамин Р- рутин или биофлаваноиды- продукты растит. Происхожд, много схожего с вит.С. Укрепляет капилляры, увелич. Прочность стенки сосуда, помогает работе щитовидк. (апельсины, брусника, клюква, укроп, свекла). Вит Н- биотин- кристаллы, хорошо раствор в H2O, устойчив при нагревании. Снижает сахар в крови, облегчает мышеч. боли, приостанавливает поседение волос. (творог, горошек, печень). Витаминоподоб вещ-ва. В13- оротовая к-та- функционирует состояние печени. В15- пангамовая к-та - в семенах растений, улучшает тканевое дыхание. H1- парааминобензойная к-та - участ в пигментации. В4- холин- хорошо растворим в H2O ив алкоголе, участв в обмене жиров, влияет на рост, входит в состав сложных липидов. В8- инозит- недостаток приводит к ожирению печени. Вт- карнитин - для стимуляции работы поджелудоч. Железы, ускоряет заживление ран. U - метилметионининсульфоний- с латинского- язва, ускоряет заживление ран. (капуста, картофель, морковь, репа, томат ы). Микроэлементы. Fe- в форме гемоглобина сущ-ет. Низкое кол-во железа- бледная кожа, анемия, сонливость, раздражимость. (мясо, яблоки, орехи, фасоль). Хром- участв в метаболиз углеводов и жиров, в процессе образования инсулина. Низкий уровень-диабет (дрожжи, сыр). Медь- дефицит- заметные вены, расстройства кишечника. (печень, крабы, оливки). Йод- регулирует функцию щитовид железы, вес, обмен в-в. (морепродукты, морские водоросли). Марганец - необходим для норм роста и развития. (овес, орехи, слива). Селен - укрепляет иммунитет, его содержание уменьшается при курении, дефицит- боли в груди, облысение. (чеснок, яйца, рыба). Сера - здоровый вид кожи (моллюски, яйца). Цинк - в костях, дефицит- потеря вкусов ощущний, замедляет рост и уменьшает аппетит (грибы, устрицы).
3. общая характеристика жирорастворимых витаминов и витаминоподобных в-в, их биологическое значение. Не вводятся с водой естественным путем. Вит А- ретинол - кристалл. В-во светло-желт. цвета, хорошо растворим в жире, может разруш-ся О2. Оказывает влияние на формирование скелета, на ночное зрение, сохраняет молодость. (печень, сливоч.мало, сыр, рыбий жир, горошек, томаты). Вит D- кальциферол- способствует укреплению зубов и костей, поддерживает уровень фосфора и Ca в крови. (зерна, молоко, яйца, сливоч.масло). Вит Е- токоферол- устойчив к нагреванию, способствует развитию мышц, предотвращ слабость и утомление, увеличивает долголетие, повышает активность витамина А, способств. норм течению беременности. (растит.масла, масло облепихи, зеленые овощи). Вит К- филлохинон- участвует в процессе свертывания крови, необходим для здоровой работы почек. (капуста, зеленые листья салата, крапива). Жирораствор витамины влияют на усвоение пищевых продуктов, позволяют наиболее полноценно усваивать жиры. Витаминоподоб вещ-ва. В13- оротовая к-та- функционирует состояние печени. В15- пангамовая к-та - в семенах растений, улучшает тканевое дыхание. H1- парааминобензойная к-та - участ в пигментации. В4- холин- хорошо растворим в H2O ив алкоголе, участв в обмене жиров, влияет на рост, входит в состав сложных липидов. В8- инозит- недостаток приводит к ожирению печени. Вт- карнитин - для стимуляции работы поджелудоч. Железы, ускоряет заживление ран. U - метилметионининсульфоний- с латинского- язва, ускоряет заживление ран. (капуста, картофель, морковь, репа, томаты). Витаминоподоб в-ва усиливают профилактич-ю активность витамина и микроэлементов.
4. Классификация липидов, их химические св-ва и биологические ф-ии. Липиды- это гетерогенная многочисленная группа органических соединений со сходными физико-химическими свойствами и структурой. По химич. строению они делятся на: простые липиды (Эфиры жир. Кислот и спиртов); конъюгированные (сложные) и производные липидов (вит. D, Е и К). Простые липиды делятся на: 1. Жиры, 2. Масла(эфиры жир. кислот и глицерола); 3. Воска (эфиры жир. кислот с длинноцепочечными алифатическими спиртами). Конъюгированные липиды делятся на: 1. Фосфолипиды (фосфатидные кислоты, лецитины, плазмалогены); 2. Гликолипиды (цероброзиды, ганглиозиды и цитолипиды); 3. Сульфалипиды; 4. Липопротеины. По функциям бывают: 1. Структурные и рецепторные компоненты мембран и клеточных поверхностей; 2. Энергетическое ДЕПО; 3. Сигнальные молекулы и биологические регуляторы. Классы липопротеинов учавствующих в переносе липидов и холестерина в организме человека: 1. Хилонекроны; 2. Липопротеины очень низкой плотности; 3. Липопротеины низкой плотности; 4. Липопротеины высокой плотности. Ф-ии липидов: 1. Структурная. В сочетании фосфолипиды с белками образуют биологические мембраны; 2.Энергетическая. В процессе окисления жиров происходит высвобождение большого количества энергии, именно она и идёт на образование АТФ; 3. Теплоизоляционная и защитная; 4. Смазывающая и водоотталкивающая; 5. Регуляторная.
5 (3).Общая характеристика биологических функций белков. Белки- высокомолекулярные органические в-ва, состоящие из соед-ых в цепочку пептидной связью L- аминокислот. В организме человека белки выполняют следующие функции: Каталитическая или ферментативная - все ферменты имеют белковую природу. Регуляторная - специал. Белки-маски осущ-ют регуляцию доставки к генам в ДНК. Рецепторная - ф-я заключ-ся в избир-ом связывании гормонов, биологически активных в-в и медиаторов на поверхности мембран или внутри клеток. Транспортная - только белки осущ-ют перенос в-в в крови, например, липопротеины, гемоглобин, трансферрин. Структурная - белки формируют в-во соед-ой ткани (коллаген, эластин, кератин, протеогликаны), участвуют в построении мембран и цитоскелета. Сократительная - сущ-ет ряд белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин). Генно-регуляторная- осуществление белками регуляции процессов в клетке или в организме, что связано с их способностью к приему и передаче информации. Трофическая - белки яв-ся источником С.S.N и др. элементов. Иммунологическая или защитная - все антитела имеют белковую природу: интерфероны, фибриногены. Сигнальная - белки участв. В передаче сигнала в клетку. Энергетическая - при расщеплении аминокислот сост-их белки, клетка получает 16-18% необходимой энергии.
8 (5).Третичная структура белка. Глобулярные и фибриллярные белки. Связи стабилизирующие третичную структуру. Примеры организации третичной структуры белков. Третичная структура- пространственное строение полипептидной цепи, структура представлена в виде запутан. Нитки, если ее положить на ладонь и покатать ее другой ладонью- в виде глобулы. В стабилизации третич. структуры принимают участие: ковалентные связи (мж двумя остатками цистеинами- дисульфидные мостики); ионные (в аминокислот остатках); водородные связи; гидрофобные (на поверхности молекул). Белки по форме клубка делят на 2 группы: глобулярные (близки к форме шара) и фибриллярные (нитевидные, близкие к форме эллипса). Пример- альбулин, кератин. Фибрилляр. белки имеют палочковобразную вытянутую форму, нерастворимы в воде и физически прочные (коллаген, эластин, миозин, фибрин- свертывает кровь). Глобулярные - водорастворимы, выполняют динамическую ф-ю- ферменты иммуноглобулины и транспортные белки гемоглобин и альбулин. Коллагены - молекулы состоят из 3 полипептидных цепей, называемых α -цепями. В состав коллагенов могут входить 3 одинаковые или разные цепи. Первичная структура α -цепей коллагена необычна, т.к каждая третья аминокислота в полипептидной цепи представлена глицином, так же имеется пролин и аланин. В коллагене отсутствуют такие аминокислоты, как цистеин и триптофан, α гистидин, метионин и тирозин находятся лишь в очень небольшом количестве. В составе первичной структуры α -цепи коллагена содержится также необычная аминокислота - гидроксилизин. Изменение в первичной структуре коллагена может приводить к развитию наследственных болезней. Э ластин - в отличие от коллагена, образующего прочные фибриллы, способные выдержать большие нагрузки, эластин обладает резиноподобными свойствами. Нити эластина, содержащиеся в тканях лёгких, в стенках сосудов, в эластичных связках, могут быть растянуты в несколько раз по сравнению с их обычной длиной, но после снятия нагрузки они возвращаются в исходную форму. Эластин содержит довольно много пролина и лизина, но лишь немного гидроксипролина; полностью отсутствует гидроксилизин.
9 (6). Принципы организации четвертичной структуры белков. Кооперативные изменения конформации субъединиц. Примеры реализации кооперативных эффектов (гемоглобин, аллостерические ферменты). Четвертичная структура- когда белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными)связями, обычно связаны гидрофильно-гидрофобными связями, при помощи водородных и ионных. Подобные белки называются олигомерами, а составляющие их индивидуальные полипептидные цепи- протомерами, мономерами или субъединицами.В результате формируется молекула в виде шара (глобуляр.белки) или нити(фибриллярные).Отдельные глобулы называются субъединицами. У гемоглобина, например, имеется по две α и β субъединицы. Наличие нескольких субъединиц -увеличивает степень насыщения кислородом.Четвертичная структура свойственна большинству ферментов. Кооперативные изменения конформации субъединиц. Субъединица – это функционально активная часть молекулы белка.Конформа́ ция- пространственное расположение атомов в молекуле определенной конфигурации, обусловленное поворотом вокруг одной или нескольких одинарных сигма-связей. Кооперативные изменения конформации субъединиц - это изменение расположения атомов в определенной молекуле всех полипептидных цепей (протомеров) четвертичной структуры белка(олигомеров) при присоединении лиганда (молекулы или ионы, связанные с центральным атомом) только к одному из белков.Конформационные изменения, произошедшие в других протомерах(цепях), облегчают присоединение следующей молекулы, что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы.Т.о каждая присоединяющаяся молекула будет присоединятся легче первой в 300 раз, а также способствует более легкому отщеплению последующих молекул. Аллостерические ферменты - это ферменты, активность которых регулируется количеством молекул субстрата и эффекторами. Они играют важную роль в метаболизме.Аллостерическая регуляция имеет большое значение в следующих ситуациях: при анаболических процессах и при катаболических процессах.Аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента.
10 (7).Денатурация и ренатурация белка. Денатурирующие факторы. Денатурация белков- это потеря белками их естественных свойств (растворимости, гидрофильности и др.) вследствие нарушения пространственной структуры их молекул.Процесс денатурации отдельной белковой молекулы, приводящий к распаду её «жёсткой» трёхмерной структуры, иногда называют плавлением молекулы. Как правило, денатурация белка необратима, но в некоторых случаях после устранения денатурирующего агента может произойти «ренатурация» — восстановление вторичной и третичной структур, свойств, т.е белки возвращают свою природную структуру. Механизмы денатурации. Любое заметное изменение внешних условий, например, нагревание или обработка белка щелочью приводит к последовательному нарушению четвертичной, третичной и вторичной структур белка. Обычно денатурация вызывается повышением температуры, действием сильных кислот и щелочей, солей тяжелых металлов, некоторых растворителей (спирт), радиации и др. Денатурация часто приводит к тому, что в коллоидном растворе белковых молекул происходит процесс агрегации частиц белка в более крупные. Наглядным примером яв-ся- образование «белка» при жарке яиц.
11 (10). Классификация, структурные компоненты и биологические функции сложных белков (хромопротеины, гемопротеины, флавопротеины, металлопротеины). Хромопротеины состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины (содержат в качестве простетической группы железо), магнийпорфирины и флавопротеины (содержат производные изоаллоксазина). Функции: уч-ют в фотосинтезе, дыхание клеток и целостного организма; транспорт O2 и CO2; ОВР; свето-и цветовосприятие и др. М агнийпорфирин вместе с белком обеспечивает фотосинтетическую активность растений, катализируя расщепление H2O на H2 и O2. Г емопротеины катализируют обратную реакцию – образование H2O, связанное с освобождением энергии. Флавопротеины содержат прочно связанные с белком простетические группы, представленные изоаллоксазиновыми. Некоторые флавопротеины содержат ионы металлов. Типичными представителями флавопротеинов, являются ксантин-оксидаза, альдегидоксидаза, ацил-КоА-дегидрогеназа и транспортирующий электроны флавопротеин.. Негемовое железо связывается с белковым компонентом, отличающимся от гемсодержащих хромопротеинов. Железо ковалентно связано с атомом серы остатка цистеина в белке. При кислотном гидролизе такого белка освобождается железо и H2S. К группе Гемопротеинов относятся гемоглобин и его производные, миоглобин, хлорофиллсодержащие белки и ферменты (вся цитохромная система, каталаза и пероксидаза). Все они содержат в качестве небелкового компонента структурно сходные железо (или магний)-порфирины, но различные по составу и структуре белки. К Металлопротеинам относятся биополимеры, содержащие белок и ионы какого-либо одного или нескольких металлов: ферритин, трансферрин, гемосидерин. Белки, координационно связанные с атомами металлов в составе сложных белков-ферментов, для которых металл служит или мостиком между белковым компонентом и субстратом, или, что более вероятно, металл в них непосредственно выполняет каталитическую функцию.
13 (26). Денатурация и ренатурация. Молекулярная гибридизация нуклеиновых кислот. Денатурация свойственна макромалекулам, имеющим пространственную организацию. Она может быть вызвана нагреванием, воздействием химических веществ, которые нарушают Ван-дер-Вальсовы взаимодействия, разрывают водородные связи, стабилизирующие вторичную и третичную структуры. При нагревании происходит разделение двунитевой ДНК на одиночные полинуклеотидные цепи. При медленном охлаждении они снова воссоединяются по принципу комплементарности, образуются двунитевая полинуклеотидная цепь ДНК – этот процесс называется ренатурацией и при быстром охлаждении она не происходит. Денатурация бывает полной и частичной, обратимой и необратимой. Необратимой будет при разрушении фосфодиэфирных связей между нуклеотидами. Гибридизация нуклеиновых кислот. Все клетки одного организма содержат абсолютно одинаковые молекулы ДНК. Поэтому, если из клеток разных тканей выделить ДНК, денатурировать её и разделить цепи, а потом смешать одноцепочечные молекулы, то одноцепочечные молекулы, выделенные из разных клеток могут полностью комплиментарно спариться- образовать совершенный гибрид ДНК-ДНК.В том случае, если смешиваются ДНК разных организмов, то степень их комплим. спарив. будет зависеть от степени родстатва организмов или видов-образуются несовершенные гибриды ДНК-ДНК.
14 (12).Понятие о ферментах. структурно-функциональная организация ферментов. Ферменты-белки обладающие каталит. активностью, способны ускорять биохим-е р-ции. По своему строению могут быть простыми и сложными белками. Простетическую (небелковую) группу ферментов называют коферментом, а белковую — апоферментом. Апоферментная и коферментная группы сами по себе неактивны, лишь соединенные друг с другом более или менее прочными связями они образуют функционально активный комплекс, получивший название холофермента. Апоферментом определяется специфичность фермента (способность его взаимодействовать только с определенным веществом (субстратом) или группой веществ); тогда как коферментная группа часто выступает в роли акцептора тех или иных отщепляемых от субстрата атомов или функциональных групп, а в некоторых случаях выполняет и каталитическую функцию. Структурно-функц. организация ферментов. Центры ферментов: молекула фермента взаимодействует с S не всей своей поверхностью, а определенными участками. На поверхности фермента различают: Активный центр (это участок фермента, который взаимодействует с S. Наиболее часто в состав актив. центров входят функциональные группы таких аминокислот: ОН – группы серина, треонина, тирозина; SН – группы цистеина; NН – группа гистидина; СООН – группы глутамата и аспартата; NН2 – группы аргинина и лизина.В сложных ферментах в активный центр входят кофакторы (небелковые компоненты): простетические группы, коферменты, ионы металлов. Активный центр является комплементарным к строению S, имеется соответствие Е и S как “ключа и замка”. В структуре активного центра выделяют: участок, который связывается с S: контактный (“якорный”) участок; каталитический участок, в состав которого входят химические группы, принимающие непосредственное участие в преобразовании S. Кроме активного центра, некоторые ферменты имеют дополнительный, регуляторный, аллостерический центр, с которым взаимодействуют аллостерические регуляторы (эффекторы, модуляторы). Аллостерические эффекторы могут быть позитивными (активаторами), которые повышают каталитическую активность фермента или негативными (ингибиторами), которые ее снижают. Активный и аллостерический центры локализуются на разных субъединицах фермента. При взаимодействии аллостерического центра с эффекторами происходят конформационные изменения активного центра фермента, что приводит к увеличению или снижению его активности. Ферменты, имеющие аллостерический центр, называются регуляторными.
15 (16). Классификация и номенклатура ферментов. Все ферменты делятся на 6 классов по типу катализируемой реакции. Каждый класс делится на несколько подклассов. Классы: 1.Оксидоредуктазы; 2.Трансферазы; 3.Гидралазы; 4.Лиазы; 5.Изомеразы; 6.Лигазы (синтетазы). 1.Оксидредуктазы – ферменты, катализирующие ОВР: а) аэробные дегидрогеназы (оксидазы). Отщепляют водород от субстрата и переносят его на молекулу кислорода, б) анаэробные дегидрогеназы – катализируют перенос водорода от субстрата на любой другой акцептор, кроме кислорода, в) цитохромы – это ферменты, переносящие электроны. г) пероксидазы – гемсодержащие оксидоредуктазы. Они отщепляют водород от субстрата и переносят его на Н2О2 2. Трансферазы – ферменты, переносящие группы атомов от одного субстрата к другому. При этом один субстрат донор, а другой – акцептор.- аминотрансферазы, переносят NH2; - метилтрансферазы, переносят CH3; - фосфотрансферазы, переносят PO3H2; - ацилтрнсферазы. 3. Гидролазы – ферменты, катализирующие разрыв одинарных связей с участием воды, присоединяемой по месту разрыва связи(они принимают участие в реакциях гидролиза). Все ферменты пищеварительного тракта относятся к гидролазам: эстеразы – разрывают сложно-эфирную связь; пептидазы – разрывают пептидную связь; гликозидазы – разрывают гликозидные связи. 4. Лиазы - ферменты осуществляют разрыв углеродных связей без участия воды. Выделяют: декарбоксилазы – катализируют отщепление CO2. альдолазы – катализируют расщепление связи между атомами углерода. гидратазы – разрыв двойной связи с присоединением воды по месту разрыва двойной связи. Ферменты, отщепляющие воду – реакция дегидратации. При этом образуется двойная связь. 5.Изомеразы – ферменты, катализирующие реакции изомеризации и обеспечивающие внутримолекулярную перестройку. 6.Лигазы (синтетазы) – катализируют образование более сложных вещ-в из более простых. При этом требуется энергия из вне. Обязательно участие АТФ или других. Номенклатура ферментов: 1)Тривиальная номенклатура – названия случайные, без системы и основания, например трипсин, пепсин, химотрипсин.2) Рабочая номенклатура – название фермента составляется из названия субстрата или продукта реакции, типа катализируемой реакции и окончание –аза, например лактатдегирогеназа. 3) Систематическая, научная - L-лактат-НАД-оксидредуктаза.4) Все ферменты имеют цифровой шифр, например ЛДГ - 1.1.1.27.Первая цифра говорит о типе катализируемой реакции, указывая на номер класса. Вторая уточняет действие фермента – номер подкласса. Третья указывает природу разрываемой связи в молекуле субстрата - подподкласс. Четвёртая – порядковый номер фермента.
16 (13). Общие принципы ферментативного катализа. Отличие ферментов от неорганических катализаторов. В основу современной теории о ферм.катализе положена теория Михаэлеса и Ментена. Ведущую роль в механизме ферментативного катализа играет образование фермент-субстратного комплекса. По этой теории весь процесс катализа можно разделить на 3 этапа: 1)образование фермент-субстратного комплекса. Происходит диффузия субстрата к ферменту и субстрат, в соответствии с принципом комплиментарности, связывается с активным центром фермента. Реагенты связаны водородными, ионными, гидрофобными, в некоторых случаях и ковалентными связями. Эта стадия непродолжительна, зависит от концентрации субстрата и от скорости диффузии его к активному центру. Энергия активации исходных веществ при этом изменяется незначительно. На этой стадии проявляется эффект концентрирования субстрата на поверхности фермента – эффект ориентации. 2)происходит последовательное преобразование первичного фермент-субстратного комплекса в 1 или несколько активированных. Эта стадия медленная, ее длительность зависит от величины энергии активации данной реакции. В эту стадию происходит разрыв старых связей и образование новых, при этом энергия активации значительно снижается. 3)отделение продуктов от активного центра фермента и диффузия их в окружающую среду. Эта стадия непродолжительна, ее скорость определяется скоростью диффузии продуктов в окружающую среду. Отличия между ферментами и неорг. катализаторами (общие свойства ферментов): сложность строения; высокая мощность действия; специфичность; это вещ-ва с регулируемой активностью; действуют в мягких условиях организма.
19 (15). Механизм действия ферментов. Специфичность действия ферментов(стереохимическая, реакционная и субстратная: абсолютная, групповая). Структура и роль каталитического центра. 1. Происходит активация фермента путем связывания с аллостерическим центром регуляторных веществ это приводит к изменению конформации активного центра фермента и увеличению его способности связывать молекулу субстрата. 2. происходит 'узнавание' ферментом своего S. 3. происходит формирование неактивного фермент-субстратного комплекса за счет образования гидрофобных и водородных связей между радикалами аминокислотных остатков субстратного центра и соответствующими группировками в молекуле S. 4. образуется активный фермент-субстратный комплекс. При этом происходит хим. преобразование S с участием каталитического центра и кофермента. В результате этого молекула S меняет свою пространственную конфигурацию, в ней происходит перераспределение энергии и уменьшается прочность связей. 5. фермент-субстратный комплекс становиться нестабильным и затем преобразуется в комплекс фермент-продукт, который распадается на продукты реакции и фермент. Фермент из реакции выходит в неизменном виде.-Специфичность по отношению к субстрату – это предпочтительность фермента к субстрату определенной структуры в сравнении с другими субстратами. Различают 4 вида субстратной специфичности ферментов: 1. Абсолютная специфичность – способность фермента катализировать превращение только одного S..2. Относительная специфичность – фермент катализирует превращение нескольких S, имеющих один тип связи. 3. Относительная групповая специфичность – фермент катализирует превращение нескольких S, имеющих один тип связи, но требуется наличие определенных функциональных групп, входящих в состав S. 4. Стереохимическая специфичность – фермент катализирует превращение только одного стереоизомера. Реакционная специфичность фермента -это специфичность фермента к определённой реакции. Каталитический центр - это та область актив. центра фермента, которая непосредственно участвует в хим. преобразованиях S. Формируется он за счет радикалов двух, иногда трех аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи. Если фермент явл-ся сложным белком, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента (кофермент). Коферментную функцию выполняют все водорастворимые витамины и жирорастворимый витамин K. Образование каталитического центра происходит одновременно с формированием третичной структуры белковой молекулы фермента. Чаще всего в его входят остатки серина, цистеина, тирозина, гистидина, аргинина, аспарагиновой и глутаминовой кислот.
20 (14). Кофакторы и коферменты, их значение для деятельности ферментов. Коферментные функции витаминов. Коферменты — это орган. вещ-ва аминокислотной природы, непосредственно участвующие в катализе в составе фермента. Простые, относятся обычно к классу гидролаз, практически все гидролитические ферменты состоят только изаминокислот. Кроме того, некоторые лиазы, а вот все остальные классы ферментов в основном явл. сложными белками(для каталитической активности многих ферментов кроме белковой части необходим второй компонент- кофактор). Есть каталитически актив. фермент вместе с кофактором- холофермент. Это каталитически актив. фермент, состоящий из белковой и небелковой части кофактора. Белковая часть холофермента- апофермент. У холофермента ни белковая часть апофермента, ни кофактор в отдельности не обладают заметной каталитической активностью. Оказывается апофермент резко повышает каталитическую активность кофактора, а кофактор в свою очередь стабилизирует белковую часть, делает ее более устойчивой и менее уязвимой к денатурирующим агентам. Кофакторы - это некоторые полипептиды, группы нуклеотидов и их производные и, наконец, ионы некоторых металлов. Классификация: 1) Кофакторы жирного ряда (глютатион, липоевая кислота, долихол фосфат). 2 Кофакторы алифатического ряда (убихинон или коэнзим Q). 3) Кофакторы гетероциклического ряда. 4) не содержащие витаминов - геминовые кофакторы. Основой этих кофакторов является гемовое железо. 5) Кофакторы-нуклеотиды. Коферментные функции витаминов. Ф-ции водорастворимых вытаминов-образование коферментов и простетич. групп ферментовитамины. Связанные с разл. витаминами ферменты принимают участие во мн. важнейших процессах обмена веществ: энергетич. обмене, биосинтезе и превращениях аминокислот, жирных кислот, пуриновых и пиримидиновых оснований. Некоторые жирорастворимые витамины также выполняют коферментные функции. Ф-ции др. жирорастворимых витаминов: витамин Е стабилизирует и защищает ненасыщ. липиды биол. мембран от окисления; витамин D необходим для осуществления транспорта ионов Са и остатков фосфорной кислоты через клеточные барьеры в процессах их всасывания в кишечнике, реабсорбции в почках и мобилизации из скелета.
21 (19). Регуляция активности ферментов. Ковалентная модификация. Аллостерическая регуляция. Каталитические и регуляторные центры. Понятие об иммобилизированных ферментов и их применение в медицине. Ферменты-регулируемые катализаторы.В качестве регуляторов могут выступать метаболиты, яды. Различают: активаторы – вещ-ва, увеличивающие скорость реакции; ингибиторы – вещ-ва, уменьшающие скорость реакции. Активация ферментов. Различные активаторы могут связываться либо с активным центром фермента, либо вне его. К группе активаторов, влияющих на активный центр, относятся: ионы металла, коферменты, сами S. Активация с помощью металлов протекает по различным механизмам: а)металл входит в состав каталитического участка активного центра; б)металл с S образуют комплекс; в)за счет металла образуется мостик между S и активным центром фермента.S также являются активаторами. При увеличении концентрации S скорость р-ции повышается. По достижению концентрации насыщения S эта скорость не изменяется. Если активатор связывается вне активного центра фермента, то происходит ковалентная модификация фермента: 1) частичный протеолиз. 2) фосфорилирование - дефосфорилирование. Аллостерическая регуляция. Аллостерич-е ферменты построены из двух или большего числа субъединиц. Одна субъединица имеет каталитический центр, др.— регуляторный центр. Если в среде есть аллостерический ингибитор, он присоединяется к регуляторному центру, что ведет к изменению конформации регуляторной субъединицы; вследствие этого изменяется конформация и каталитической субъединицы, в том числе каталитического активного центра. В результате активность фермента снижается. Чем выше концентрация аллостерического ингибитора, тем больше молекул фермента блокируется им и тем меньше скорость превращения субстрата. Аналогично происходит и активация ферментов при действии аллостерических активаторов. Иммобилизованные ферменты – это ферменты, ковалентно присоединенные к любому органическому или неорганическому полимеру. Их можно многократно использовать, при этом их активность снижается незначительно. При этом обеспечивается их высокая специфичность действия и высокая стабильность. В медицине иммобилизованные ферменты используются как лекарственные препараты.
22(18).Ингибирование активности ферментов: обратимое и необратимое; конкурентное, неконкурентное и бесконкурентное. Ингибитор – это вещ-во, вызывающее специфическое снижение активн-ти фермента. Инактивация –денатурация белка в результате действия денатурирующих агентов. По прочности связывания ингибитора с ферментом ингибиторы делят на обратимые и необратимые. Необратимые ингибиторы прочно связаны и разрушают функциональные группы молекулы фермента, которые необходимы для проявления его каталитической активн-ти. Обратимые игнибиторы, например прозерин для холинэстеразы. Обратимое ингибирование зависит от концентрации субстрата и ингибитора и снимается избытком субстрата. По механизму действия выделяют: 1) Конкурентное (изостерическое) ингибирование – это торможение ферментативной р-ции, вызванное связыванием ингибитора с активным центром фермента. При этом ингибитор имеет сходство с S. В процессе происходит конкуренция за активный центр: образуются фермент-субстратные и ингибитор-ферментные комплексы.2) Неконкурентное ингибирование – торможение, связанное с влиянием ингибитора на каталитическое превращение, но не на связывание фермента с S. В этом случае ингибитор может связываться и с активным центром (каталитический участок) и вне его. Присоединение ингибитора вне активного центра приводит к изменению конформации (третичной структуры) белка, вследствие чего изменяется конформация активного центра. Это затрагивает каталитический участок и мешает взаимодействию субстрата с активным центром. Неконкурентные ингибиторы: а) цианиды. Они связываются с атомом железа в цитохромоксидазе и в результате этого фермент теряет свою активность, а т.к. это фермент дыхательной цепи, то нарушается дыхание клеток и они гибнут. б) ионы тяжёлых металлов и их органические соединения. в) фармакологические средства, которые должны поражать ферменты злокачественных клеток. Сюда же относятся ингибиторы, использующиеся в сельском хозяйстве, бытовые отравляющие вещества.3) Субстратное ингибирование (бесконкурентное) – торможение ферментативной реакции, вызванное избытком S. Происходит в результате образования фермент-субстратного комплекса, неспособного подвергаться каталитическому превращению. Лекарственные препараты как конкурентные ингибиторы. Например.: четвертичные аммониевые основания ингибируют ацетилхолинэстеразу, катадизирующую реакцию гидролиза ацетилхолина на холин и уксусную кислоту. При добавлении ингибиторов активность ацетилхолинэстеразы уменьшается, концентрация ацетилхолина(S) увеличивается, что сопровождается усилением проведения нервного импульса. Ингибиторы холинэстеразы используют при лечении мышечных дистрофий.
23. Применение ферментов в медицине. Понятие об энзимопатологии, энзимодиагностике и энзимотерапии. 1. Химический метод – количественное определение S или продуктов с помощью хим. реагентов. 2. Спектрофотометрический метод – измерение скорости ферментативной реакции по изменению поглощения S при характеристической длине волны. 3. Манометрический метод – определение кол-ва газа, выделяющегося в процессе р-ции (оксидазы – по поглощению О2, декарбоксилазы – по выделению СО2). 4. Поляриметрический метод – фиксируется изменение оптического вращения. 5. Хроматографический – количественное определение S или продуктов с помощью различных видов хроматографии: бумажной (анализ сахаров), тонкослойной (гликозидов со сложными агликонами). Удельная активность – это число единиц активности (Е) на мг белка. Энзимопатология -заболевания, которые обусловлены отсутствием или снижением активности ферментов. В основном это – наследственные болезни, обусловленные генетическими нарушениями(дефекты ферментов обмена фенилаланина возникают при снижении активности фенилаланингидроксилазы-фенилпировиноградная олигофрения). Энзимодиагностика это использование определения активности ферментов в биологиче ских жидкостях для выявления тех или иных заболеваний. Энзимотерапия это использование ферментных препаратов для лечения заболеваний.
24 (22). Структурные компоненты нуклеиновых кислот. Биологическое значение и функции нуклеиновых кислот. Нуклеиновая к-та — высокомолекулярное органическое соединение, полинуклеотид, образованный остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют функции по хранению, передаче и реализации наследственной информации. В состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые - аденин (А), гуанин (G) и пиримидиновые - цитозин (С), тимин (Т) и урацил (U).Одна из основных функций нуклеиновых кислот состоит в детерминации синтеза белков. Информация о структуре белков, закодированная в нуклеотидной последовательности ДНК.
25. Вторичная и третичная структура ДНК. Типы РНК и их ф-ции. Вторичная структура ДНК -двойная спираль. Эта структура образуется из двух взаимно комплементарных антипараллельных полидезоксирибонуклеотидных цепей, закрученных относительно друг друга и общей оси в правую спираль. При этом азотистые основания обращены внутрь двойной спирали, а сахарофосфатный остов — наружу. В формировании вторичной структуры ДНК участвуют: а)водородные связи между комплементарными основаниями; б)электростатические взаимодействия; в)Ван-дер-Ваальсовы взаимодействия(связи между положительными и отриц. ионами). Третичная структура (клубок) — пространственное строение всей молекулы белка или другой макромолекулы, состоящей из единственной цепи. В формирование этой цепи участвуют: а)ковалентные связи (между двумя остатками цистеина — дисульфидные мостики); б)ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; в)водородные связи; г)гидрофильно-гидрофобные взаимодействия. На поверхности молекулы оказываются полярные гидрофильные боковые группы. Типы РНК и их функции. Три типа РНК: – транспортные (тРНК), матричные (мРНК) и рибосомальные (рРНК). Они различаются по первичной структуре, молекулярной массе, конформации, продолжительности жизни и выполняемым функциям. Транспортные РНК -описывается универсальной моделью «клеверного листа». В состав тРНК входят минорные основания, представленные метилированными основаниями, изомерами и аналогами пиримидинов. Минорные основания делают тРНК устойчивыми к действию нуклеаз и поддерживают определенную третичную структуру молекулы. Антикодон имеет жесткую архитектуру, которая позволяет ему быстро считывать мРНК. Матричные РНК эукариот и прокариот различаются по строению. Этот тип РНК имеет одинаковое строение 5′ - и 3′ -концов.На 5′ конце присутствует модифицированный нуклеотид 7-метилгуанозин-5′ -трифосфат – кэп. Рибосомальные РНК принимают участие в образовании рибонуклеопротеинов, формирующих немембранные комплексы – рибосомы. Клетки прокариот и эукариот содержат рибосомы, имеюшие общий план строения. В рибосомы входят высокомолекулярные рРНК, дающие начало 30S-40S- и 50S-60S-субчастицам рибосом; рРНК взаимодействуют с мРНК и аминоацил-тРНК в процессе трансляции. рРНК содержат несколько модифицированных нуклеотидов. Чаще всего это метильные производные азотистых оснований или рибозы. Вторичная структура рРНК характеризуется спирализацией самой на себя полирибонуклеотидной цепи. Биспиральные и линейные участки этих молекул формируют постоянные вариабельные домены, которые затем укладываются в более компактные структуры более высокого порядка.
26 (23). Строение и уровни организации нуклеиновых кислот. Первичная структура нуклеиновых кислот. Видовые различия первичной структуры нуклеиновых кислот. Нуклеиновая к-та — высокомолекулярное органическое соединение, полинуклеотид, образованный остатками нуклеотидов. В состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые - аденин (А), гуанин (G) и пиримидиновые - цитозин (С), тимин (Т) и урацил (U). Уровни структурной организации: 1. первичная структура. РНК и ДНК построены однотипно – представлены полинуклеотидной цепью, состоящей из отдельных мононуклеотодов, соединённых между собой 3’→ 5’-фосфодиэфирными связями. 2. вторичная структура. Представляет собой двойную спираль, состоящую из 2 полинуклеотидных цепей, закрученных вокруг одной общей оси. Эти цепи антипараллельны, т.е. одна идет в направлении 5’→ 3’, а другая 3’→ 5’. Пуриновому основанию одной цепи соответствует пиримидиновое основание другой цепи – эти основания комплиментарны друг другу. Вторичная структура стабилизируется водородными связями и гидрофобными взаимодействиями. Видовые различия первичной структуры: Существуют два типа нуклеиновых кислот – дезоксирибонуклеиновые кислоты (ДНК) и рибонуклеиновые кислоты(РНК). те, и другие представляют собой полимерные молекулы, построенные из мономерных блоков – нуклеотидов: ДНК – из дезоксирибонуклеотидов, а РНК – из рибонуклеотидов.
27 (24). Вторичная и третичная структура ДНК. Строение и организация хроматина. Вторичная структура ДНК -двойная спираль. Эта структура образуется из двух взаимно комплементарных антипараллельных полидезоксирибонуклеотидных цепей, закрученных относительно друг друга и общей оси в правую спираль. При этом азотистые основания обращены внутрь двойной спирали, а сахарофосфатный остов — наружу. В формировании вторичной структуры ДНК участвуют: а)водородные связи между комплементарными основаниями; б)электростатические взаимодействия; в)Ван-дер-Ваальсовы взаимодействия(связи между положительными и отриц. ионами). Третичная структура (клубок) — пространственное строение всей молекулы белка или другой макромолекулы, состоящей из единственной цепи. В формирование этой цепи участвуют: а)ковалентные связи (между двумя остатками цистеина — дисульфидные мостики); б)ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; в)водородные связи; г)гидрофильно-гидрофобные взаимодействия. На поверхности молекулы оказываются полярные гидрофильные боковые группы. Хроматин -это вещ-во хромосом — комплекс ДНК, РНК и белков. Хроматин находится внутри ядра клеток эукариот и входит в состав нуклеоида у прокариот. Именно в составе хроматина происходит реализация генетической информации, а также репликация и репарация ДНК. Основную массу хроматина составляют белки гистоны. Гистоны являются компонентом нуклеосом, — надмолекулярных структур, участвующих в упаковке хромосом. Нуклеосомы располагаются довольно регулярно, так что образующаяся структура напоминает бусы. Нуклеосома состоит из белков четырех типов: H2A, H2B, H3 и H4. В одну нуклеосому входят по два белка каждого типа. Нить ДНК с нуклеосомами образует нерегулярную структуру (фибриллу). Если хроматин упакован плотно- гетерохроматин, ДНК, находящаяся в гетерохроматине не транскрибируется. В интерфазе гетерохроматин обычно располагается по периферии ядра (пристеночный гетерохроматин). Полная конденсация хромосом происходит перед делением клетки. Если хроматин упакован неплотно- эухроматином. Плотность упаковки хроматина во многом определяется модификациями гистонов — ацетилированием и фосфорилированием..
30 (29). Биосинтез РНК (транскрипция). Строение РНК-полимеразы. Зависимость локализации считываемого участка и направления считывания от структуры промотора. Этапы транскрипции. Посттранскрипционная модификация РНК. Процессинг РНК. Транскрипция - передача информации с ДНК на РНК. Элементарная единица транскрипции-оперон (транскриптон)- участок ДНК, подвергающийся транскрипции. В опероне выделяют информативные участки - экзоны и неинформативные участки - интроны. В начале оперона выделяют промотор (P) - это начальный участок оперона, к которому присоединяется РНК-полимераза. Рядом с промотором располагается оператор (О) - регуляторная зона, место присоединения генов-регуляторов. В конце оперона располагается терминатор (Т) - участок, содержащий стоп-сигнал. Строение РНК-полимеразы. Биосинтез РНК осуществляется ДНК-зависимыми РНК-полимеразами. В ядрах эукариотов обнаружены 3 специализированные РНК-полимеразы: РНК-полимераза I, синтезирующая пре-рРНК; РНК-полимераза II, ответственная за синтез пре-мРНК; РНК-полимераза III, синтезирующая пре-тРНК. Этапы транскрипции: 1. инициация; 2. элонгация; 3. терминация; 4.процессинг (созревание) РНК. Инициация - присоединение ДНК-зависимой РНК-полимеразы к промотору, что приводит к разрыву водородных связей между комплементарными нуклеотидами и расхождение нитей ДНК. Элонгация - это передвижение РНК-полимеразы вдоль нити ДНК, сопровождающееся образованием фосфодиэфирных связей между рибонуклеотидами. Присоединение рибонуклеотидов происходит в соответствии с принципом комплементарности. Этот синтез идет от 5' конца к 3'. Данная фаза протекает до тех пор, пока ДНК-полимераза не достигнет стоп-сигнала-> терминация. В результате процессов транскрипции образуется транскрипт (пре-иРНК). Он почти полностью соответствует транскриптону. Посттранскрипционная модификация РНК. Процессинг РНК. Начинается следующий этап - процессинг - посттранскриптационное созревание РНК. Это удаление излишков - вырезаются неинформативные участки; сплайсинг - сшивка, соединение информативных участков. При этом иРНК укорачивается.Из пре-иРНК образуется иРНК. Далее иРНК соединяется с белком-информером, в результате чего образуется комплекс иРНК+ белок =информосома, который может выходить из ядра и транспортироваться в цитоплазму к рибосоме, где начинается – трансляция.
32 (31 функционирования рибосом. Роль РНК в процессе трансляции. Участие белковых комплексов инициации, элонгации и терминации в биосинтезе полипептидной цепи. Трансляция - перевод генетического текста иРНК в последовательность аминокислот в белке. Этапы трансляции: 1. Рекогниция. Происходит связывание АК со свое ). Этапы трансляции. Состав трансляционного аппарата клетки. Строение и механизм й тРНК. 2. Инициация. Состоит из 7 фаз: а) подготовка рибосомы к трансляции. Рибосома взаимодействует с фактором инициации, в результате разделяется на малую и большую субъединицы. б) подготовка РНК-матрицы к трансляции; в) подготовка инициаторной аминоацил-тРНК. г) образование инициирующего комплекса. д) связывание мРНК с инициирующим комплексом. е) поиск и комплементарное взаимодействие со стартовым кодоном. ж) формирование 80S-рибосомы. В образовавшейся рибосоме выделяют 2 участка: Р-участок, там будет происходить образование пептидных связей; А-участок (аминоацильный участок) – служит для присоединения аминоацильной- тРНК. 3. Элонгация состоит из 3-х фаз: а) присоединение следующей аминоацил-тРНК в соответствии со смыслом следующего кодона матрицы; б) пептизация; в) транслокация или перемещение. Рибосома перемещается на 1 кодон в направлении 3’-конца тРНК. При достижении рибосомой нонсенс-кодона элонгация прекращается и наступает терминация. 4. Терминация. Нонсенс-кодон распознается белковыми R-факторами (факторы освобождения) в А-участке рибосом. В результате действия R-факторов обеспечивается диссоциация элементов трансляционного аппарата и в цитоплазму высвобождаются рибосома, иРНК, полипептид. Трансляция включает 3 этапа: инициация, элонгация, терминация. 5. Процессинг белка - Это совокупность изменений в структуре белка, которые заканчиваются формированием структурно и функционально зрелой белковой молекулы.он может быть 2-х видов: а)котрансляционный, протекающий во время трансляции; б)посттрансляционный – химическая модификация белка происходит после трансляции. Рибосомы. Каждая рибосома состоит из малой и большой субъединиц. Содержит рРНК, а также около 80 различных белков, в том числе и ферментов. Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК. мРНК связывается с малой субъединицей рибосомы, когда происходит узнавание 3'-концом 16S рибосомной РНК комплементарной последовательности Шайн-Далгарно, расположенной на 5'-конце мРНК, а также позиционирование стартового кодона мРНК на малой субъединице. У эукариот малая субчастица рибосомы связывается также с помощью кэпа, на конце мРНК. Ассоциация малой и большой субъединиц происходит при связывании формилметионил-тРНК и участии факторов инициации. Таким образом, распознавание антикодона происходит на малой субъединице.
33. Регуляция биосинтеза белка на уровне репликации и транскрипции. Регуляция биосинтеза белка на этапе трансляции. Посттрансляционная модификация белков. Основные уровни регуляции биосинтеза: 1. Регуляция синтеза белка на стадии репликации. Регуляция возможна путем добавления (или удаления) кодирующих (или регуляторных) участков на ДНК. Если удалить матрицу, то и синтеза белка с нее не будет, а если увеличить дозу определенного гена в ДНК, то появится возможность ускорить построение белков на многих одинаковых матрицах. В большинстве случаев наличие избыточной генетической информации отрицательно сказывается на жизнеспособности клеток, а ее недостаток, возникающий из-за недорепликации ДНК, приводит к их гибели из-за отсутствия жизненно важных генов. 2. На уровне транскрипции.
Варианты: а)групповая репрессия генов белками – гистонами; б)амплификация генов - увеличение числа копий заданного участка ДНК или гена. в)регуляция сигналами-усилителями. Сигналы-усилители - энхансеры - выступающий участок ДНК, который может быть значительно удален от промотора. 3. регуляция на уровне трансляции: тотальная репрессия или активация трансляции при изменении активности и количества белковых факторов; избирательная дискриминация иРНК; механизм повышения эффективности трансляции включает образование полисом - это комплекс нескольких рибосом с одной иРНК. 4. Регуляция биосинтеза белков путем посттрансляционной модификации: приводила к образованию общей полипептидной цепи, разрезаемой в дальнейшем на индивидуальные белки специфическими протеиназами. Посттрансляционная модификация белков. Модификации происходят в ЭПС и аппарате Гольджи. Однако множество других ковалентных модификаций протекает в первую очередь именно в цитозоле. Некоторые из них стабильны и необходимы для активности белка. Посттрансляционные модификации включают в себя фосфорилирование факторов транскрипции протеинкиназами, гликозилирование, ацилирование, циклизацию, амидирование, гидроксилирование и метилирование различных остатков аминокислот. Многие из перечисленных модификаций являются критическими для биологической активности пептидов.
44.Метаболизм и его категории. Характерные черты метоболизма. Общие принципы организации обмена вещ-в. Метаболизм -совокупность хим. процессов, обеспечивающих жизнедеятельность организма.Состоит из 3 категорий: катаболизм (распад), анаболизм (биосинтез), анфиболизм (общая часть). Катаболизм - совокупность процессов, в которых поступившие в клетку S расщепляются до более простых продуктов=> запасается энергия, используемая затем на нужды клетки. Анаболизм -из образовавшегося при катаболизме набора конечных продуктов клетка синтезирует большое количество необходимых ей в-в. Анфиболизм -включает конечные этапы катаболизма и начальные этапы анаболизма. Он выполняет 2 функции: а)коллекторная- собирает конечные продукты катаболизма в определенных метаболитических путях; б)перераспределяет их по анаболитическим путям в зависимости от потребностей клетки. Характерные черты метаболизма: 1)принцип минимум: поток энергии и веществ в клетке является минимальным возможным в данных условиях; 2)гибкость и управляемость: быстрое перераспределение потока в-ва и энергии при изменении условий окружающей среды; 3)направленность и энергетическая стабильность: метаболизм направлен на поддержание уровня организации живой системы. 4)последовательность: все реакции обмена в-в осуществляются в определенном порядке и в соответствии со стехиометрией; 5) универсальность: большинство реакций обмена в-в одинаковы во все живых системах. Принципы организации обмена в-в: 1)весь обмен в-в разделен на метаболические блоки реакций, которые могут быть организованы по линейному или циклическому принципу. Продукт деятельности одного блока является субстратом для другого.2)метаболиты к которым сходятся несколько блоков-ключевые; 3) все клетки организованы по принципу компартментализации. Компартмент- это часть клетки, отделяющаяся от остальных мембраной. В каждом компартменте осуществляется свой набор метаболитических блоков; 4)большинство S в клетке являются инертными; 6)для активации S и обеспечения нормальной деятельности клетки некоторое количество носителей энергии и ключевых метаболитов, сосредоточено в ней в виде пулов; 7)регуляция обмена в-в в клетке осущ.при помощи концентрации «узких мест», что существенно уменьшает кол-во точек контроля; 8)регуляция обмена в-в на осущ.при помощи нервной системы и гормонов.
45 (44).характерные черты и котегории метаболизма. Компартмелизация как способ организации живых систем.уровни и принципы организации метаболизма. Метаболизм(обмен вещ-в)-это совокупность процессов превращения вещ-в и энергии в организме, происходящие с участием ферментов. Характерные черты: Метаболизм обеспечивает организм энергией, полученных при расщепление пищевых вещ-в или путем преобразования энергии солнца. Обеспечивает превращение пищевых молекул в предшественники. Обеспечивает пластическое и энергетическое поддержание структуры организма. Синтезирует и разрушает биомолекулы, которые выполняют специальные функции в организме. Сущ-ет 2 категории: катаболизм и анаболизм. Катаболизм- ферментативное расщепление крупных пищевых молекул (углеводов, липидов, белков) до более простых (H2O, CO2, NH3) с выделением энергии и запасанием ее в виде АТФ или восстановительных эквивалентов. Включает 3 стадии: 1) Переваривание, протекает в ЖКТ. Происходит превращение: полимеров в мономеры-крахмал и гликоген-в глюкозу, белки-в аминокислоты, триацилглицеролы-в жир.к-ты и глицерол, нукл к-ты-в нуклеотиды. 2) Специфические пути катаболизма. Мономеры превращаются в пируват и ацетил-КоА. 3) Общий путь катаболзима. Окисление ацетил-КоА до CO2 и H2O. Эта стадия включает цикл трикарбоновых к-т, цепи переноса электронов и окислительное фосфорилирование. Анаболизм- синтез крупных полимерных молекул из простых предшественников с затратой АТФ или НАДН, НАДФН, ФАДН2. Включает 3 стадии: 1) Цикл трикарбоновых кислот, 2) Образование мономеров по реакциям, обратным реакциям катаболизма. 3) Синтез полимеров из мономеров. Компартментализация- это сосредоточение ферментов в одном компартменте (определенной органелле) -в ЭПС, митохонд, лизосомах. Например в митохондриях- расположены ферменты β оксиления жир.к-т, цикла трикарбон.к-т, дыхательной цепи. В рибосомах- ферменты синтеза белка. В цитоплазме- ферменты гликолиза, глюконеогенеза, ПФПути, биосинтеза липидов, пуринов, пиримидинов. Регуляция метаболизма: Она обеспечивает синтез вещ-в, контроль кол-ва поступаемых пит.веществ. В результате уменьшения или увеличения скорости специфич. р-ций, клетка реагирует быстро на изменение условий окр.среды (t, pH, концентрацию пит.в-в). Сущ-ет 3 механизма регуляции метаболизма: 1)Изменение активности ферментов - самый распространен. способ. Регуляции подвержены основные ферменты, которые определяют скорость всего процесса. 2) Изменение кол-ва фермента в клетке-осущ-ся путем индукции или репрессии генов 3)Изменение проницаемости мембран. В организме человека координация метаболизма осущ-ся нервной и эндокрин.системами. Нерв сист.отвеч.за быструю реакцию на изменение окр.среды. В эндокрин.сист.секретир-ся гормоны, которые поступают в кровь.
46 (48). Общий путь катаболизма. Катаболизм -ферментативное расщепление крупных пищевых молекул(углеводов, липидов, белков) до более простых(H2O, CO2, NH3) с выделением энергии и запасанием ее в виде АТФ или восстановительных эквивалентов(НАДН, НАДФН, ФАДН2). Включает 3 стадии: 1) Переваривание, протекает в ЖКТ. Происходит превращение: полимеров в мономеры-крахмал и гликоген-в глюкозу, белки-в аминокислоты, триацилглицеролы-в жир.к-ты и глицерол, нукл к-ты-в нуклеотиды. При этом высвобождается около 1% энергии и рассеивается в виде тепла. 2) Специфические пути катаболизма. Мономеры превращаются в пируват и ацетил-КоА. Локализация 2 стадии-цитоплазма и митохондрии. Часть энергии рассеивается в виде тепла и примерно 13 % энергии вещ-ва усваивается. 3) Общий путь катаболзима. Все реакции этого этапа протекают в митохондриях. Окисление ацетил-КоА до CO2 и H2O. Эта стадия включает цикл трикарбоновых к-т, цепи переноса электронов и окислительное фосфорилирование. В результате окислительного фосфорилирования образ-ся H2O и АТФ. Часть выделенной энергии рассеивается в виде тепла и около 46 % энергии усваивается, т.е запасается в связях АТФ и ГТФ.
47. (48) Окислительное декарбоксилирование пирувата: реакции. Характеристика и состав полиферментного комплекса. Медицинские аспекты. происходит в матриксе митохондрий. ПВК в клетках образуется из глюкозы, ряда аминокислот, молочной кислоты и глицерина. Окисление пирувата до ацетил-КоА происходит при участии ряда ферментов и коферментов: три фермента: пируватдегидрогеназа; трансацетилаза; дигидролипоилдегидрогеназа. пять коферментов: тиаминдифосфат; амид липоевой кислоты; коэнзим A; флавин-аденин-динуклеотид; никотинамид-аденин-динуклеотид (НАД). Суммарную реакцию, катализируемую пируватдегидрогеназным комплексом, можно представить следующим образом: Пируват + НАД+ + коэнзим А –> Ацетил-КоА + НАДН + Н+ + СO2. Реакция сопровождается значительным уменьшением стандартной свободной энергии и практически необратима. Образовавшийся в процессе окислительного декарбоксилирования ацетил-КоА подвергается дальнейшему окислению с образованием СО2 и Н2О. Полное окисление ацетил-КоА происходит в цикле трикарбоновых кислот (цикл Кребса). Этот процесс, так же как окислительное декарбоксилирование пирувата, происходит в митохондриях клеток.
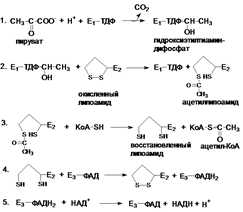
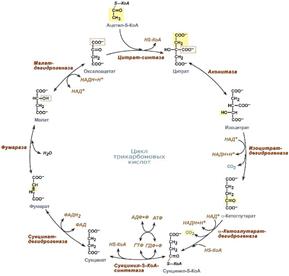
48 (49). Цикл Кребса: последовательность реакций, биохимическое значение, регуляция. Восстановительные эквиваленты как носители энергии типы дегидрогеназ. Цикл лимонной кислоты (цикл Кребса, цикл три- карбоновых кислот) - представляет собой реакции, протекающие в митохондриях, в ходе которых осуществляются катаболизм ацетильных групп и высвобождение водородных эквивалентов. В состав СоА входит витамин — пантотеновая кислота. ЦТК включает в себя 8 стадий (10 реакций): 1) Цикл начинается с взаимодействия молекулы ацетил-СоА с щавелевоуксусной кислотой (оксалоацетатом), в результате образуется лимонная кислота (цитрат). 2)цитрат превращается в изоцитрат через цис-аконитат. 3)изоцитрат дегидрируется с образование α - кетоглутарата и СО2 4) α - кетоглутарата окисляется до сукцинилСоА и СО2. 5) сукцинилСоА превращается в сукцинат. 6)сукцинат ддегидрируется с образованием фумарата. 7)фумарат дигидрируется с образованием малата. 8)малат дигидрируется с образованием оксалацетата. Значение: Главная функция цикла лимонной кислоты состоит в том, что он является общим конечным путем окисления углеводов, липидов и белков, поскольку в ходе метаболизма глюкоза, жирные кислоты и аминокислоты превращаются либо в ацетил-СоА, либо в промежуточные соединения рассматриваемого цикла. Цикл лимонной кислоты играет также главную роль в процессах глюконеогенеза, переаминирования, дезаминирования и липогенеза. О жизненно важной роли цикла лимонной кислоты свидетельствует и тот факт, что у человека почти неизвестны (или их вообще нет) генетически обусловленные изменения ферментов, катализирующих реакции цикла; вероятно, наличие таких нарушений несовместимо с нормальным развитием.