
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Скорости химических реакций. Энергия активации.
|
|
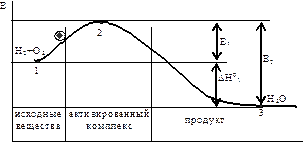 Скоростью химической реакции (υ) принято считать количество вещества, реагирующего в единицу времени (dt) в единице объема (dV). По гипотезе Аррениуса реакция между молекулами проходит лишь в том случае, если они являются активными, т.е. обладают избыточной энергией, достаточной для разрыва межатомных связей, так называемой энергией активации ЕА. Т.е. скорость химической реакции зависит не от количества столкновений всех молекул, а только активированных скорость реакции пропорциональна концентрации активных молекул, число которых зависит от температуры и давления в смеси, так как давление и есть количество молекул, сталкивающихся с какой-либо поверхностью реакция возможна лишь в том случае, если взаимодействующие молекулы получают определенный запас энергии, достаточный для разрыва или ослабления межатомных связей. Активация заключается в переходе молекул в такое состояние, в котором возможно химическое превращение. Минимальное количество тепловой энергии, необходимое для «запуска» химической реакции, называется энергией активации
Скоростью химической реакции (υ) принято считать количество вещества, реагирующего в единицу времени (dt) в единице объема (dV). По гипотезе Аррениуса реакция между молекулами проходит лишь в том случае, если они являются активными, т.е. обладают избыточной энергией, достаточной для разрыва межатомных связей, так называемой энергией активации ЕА. Т.е. скорость химической реакции зависит не от количества столкновений всех молекул, а только активированных скорость реакции пропорциональна концентрации активных молекул, число которых зависит от температуры и давления в смеси, так как давление и есть количество молекул, сталкивающихся с какой-либо поверхностью реакция возможна лишь в том случае, если взаимодействующие молекулы получают определенный запас энергии, достаточный для разрыва или ослабления межатомных связей. Активация заключается в переходе молекул в такое состояние, в котором возможно химическое превращение. Минимальное количество тепловой энергии, необходимое для «запуска» химической реакции, называется энергией активации
энергия активации – это энергия, необходимая для превращения реагирующих веществ в состояние активного комплекса (разрыв межатомных связей, сближение молекул, накопление энергии в молекуле…).
С повышением температуры газов резко увеличивается доля активных молекул (е-Е/RT), а значит скорость реакции по экспоненциальной зависимости.
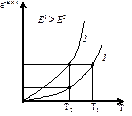
Зависимость скорости реакции от температуры: 1 – скорость 1-ой реакции, 2 – скорость 2-ой реакции
Когда Е больше, то существующие межатомные связи в молекулах реагирующих компонентов сильнее, и нужно больше энергии на преодоление этих сил. При этом доля активных молекул соответственно меньше. Энергии активации является важнейшей характеристикой химического процесса. Она определяет высоту энергетического барьера, преодоление которого представляет собой условие протекание реакции. С другой стороны, она характеризует скорость реакции от температуры, т.е. чем выше энергия активации, тем выше температура для достижения заданной реакции