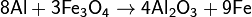Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Глава 5. Химические свойства
|
|
Гидроксид алюминия
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°), O2, HNO3 (без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной промышленностью. Однако при разрушении оксидной плёнки (например, при контакте с растворами солей аммония NH4+, горячими щелочами или в результате амальгамирования), алюминий выступает как активный металл-восстановитель. Не допустить образования оксидной плёнки можно, добавляя к алюминию такие металлы, как галлий, индий или олово. При этом поверхность алюминия смачивают легкоплавкие эвтектики на основе этих металлов[11].



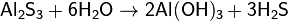
Легко реагирует с простыми веществами:
с кислородом, образуя оксид алюминия:

с галогенами (кроме фтора)[12], образуя хлорид, бромид или иодид алюминия:

с другими неметаллами реагирует при нагревании:
со фтором, образуя фторид алюминия:

с серой, образуя сульфид алюминия:

с азотом, образуя нитрид алюминия:

с углеродом, образуя карбид алюминия:

Сульфид и карбид алюминия полностью гидролизуются:

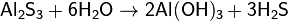
Со сложными веществами:
с водой (после удаления защитной оксидной плёнки, например, амальгамированием или растворами горячей щёлочи):

со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов):


Легко растворяется в соляной и разбавленной серной кислотах:
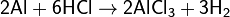

При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия:

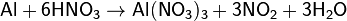
восстанавливает металлы из их оксидов (алюминотермия):