
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Сухое разложение солей карбоновых кислот
|
|
Из дигалогенопроизводных
CL OH
̷ +2NaOH ̷ -H₂ O
R-C-CL-----------→ R-C-OH--------→ R-C=O
│ -2NaCL │ │
R R R
Сухое разложение солей карбоновых кислот
f
СН3-С-O-Ca-O-C-CH3→ CH3-C-CH3+Ca₂ CO3
│ │ │ │ │ │
O O O
Химические свойства

2) гидрирование кетонов в присутствии катализаторов приводит к образованию вторичных спиртов.
Кетоны окисляются значительно труднее альдегидов и только сильными окислителями. При окислении кетонов происходит разрыв (деструкция) углеродной цепи, и образуется смесь продуктов. Кетоны не вступают в реакцию «серебряного зеркала».
Получение:
1) кетоны образуются при окислении или каталитическом дегидрировании вторичных спиртов в присутствии медных катализаторов, например:

2) как и альдегиды, кетоны можно получить гидролизом дигалогенпроизводных алканов. Чтобы получился кетон, оба атома галогена в исходном соединении должны находиться при одном (не крайнем) атоме углерода:

3) кетоны образуются в результате присоединения воды к гомологам ацетилена в присутствии катализаторов – солей ртути (II), например:

23. Общность и различие химических свойств альдегидов и кетонов.

24. Одноосновные карбоновые кислоты. Способ получения кислот.
- это кислоты, являющиеся производными предельных углеводородов и содержащие одну карбоксальную группу.
H-COOH метановая, муравьиная
CH3-COOH этановая, уксусная
CH3-CH₂ -COOH пропановая, пропионовая
СН3-(СН₂)₂ -СООН бутановя, масляная
СН3-(СН₂)3-СООН пентановая, валерьяновая
СН3-(СН₂)4-СООН гексановая, капроновая
1. В природных условиях некоторые кислоты встречаются в виде сложных эфиров, из которых их можно получить путем гидролиза:
R-СО-О-R' + Н2O < -> R-СООН + R'-ОН
2. Окисление альдегидов и первичных спиртов. В качестве окислителей применяются КМnO4, K2Cr2O7, HN03:

3. Окисление кетонов приводит к образованию кислот с меньшим числом атомов углерода в молекуле, чем в исходном кетоне см. Реакции окисления раздела Карбонильные соединения.
4. Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия:
5С6Н5-СН3 + 6КМn04 + 9H2S04 -= 5С6Н5СООН + 3K2S04 + 6MnS04 + 14Н20
5. Использование реактива Гриньяра по схеме:

6. Гидролиз галогенозамещенных углеводородов, содержащих три атома галогена у одного атома углерода:
R-ССl3 ---NaOH--> [R-С(ОН)3] -> R-СООН + Н20
25. Химические свойства односновных предельных кислот.
Химические свойства карбоновых кислот определяются теми электронными эффектами, которые действуют в карбоксильной группе и молекуле в целом.

Электронная структура молекулы позволяет выделить следующие основные направления протекания химических реакций карбоновых кислот:
― реакции с разрывом связи О-Н (направление I);
― реакции с разрывом связи С-О (направление II);
― реакции в углеводородном радикале (направление III).
I. Кислотно-основные свойства кислот (направление I). Влияние кислорода карбонильной группы приводит к накапливанию частично положительного заряда на атоме углерода, что в свою очередь, за счет индукционного эффекта, приводит к значительному снижению электронной плотности на кислороде гидроксильной группы, вследствие чего протон практически не удерживается, легко отрывается и кислоты обладают ярко выраженными кислотными свойствами.

Диссоциация кислот с отрывом протона выгодна и энергетически, так как при этом образуется карбоксилат анион, стабилизированный резонансом и обладающий меньшей энергией, чем исходная кислота. Карбоксилат-анион является гибридом двух структур (1 и 2), стабилизированных резонансом. В карбоксилат-анионе атом находится в состоянии sp2- гибридизации. Не спаренный p- электрон углерода одинаково равномерно перекрывается с p- электроном двух атомов кислорода.
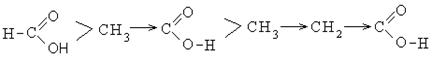
Присутствие галогена в алкильном радикале усиливает кислотные свойства кислот. Наиболее сильной кислотой является трихлоруксусная кислота. Легкость отрыва протона в трихлоруксусной кислоте объясняется отрицательным индукционным эффектом галогена, что уменьшает электронную плотность на карбоксилат-анионе и дестабилизирует его.
 Кислотность галогензамещенных карбоновых кислот изменяется в следующем порядке:
Кислотность галогензамещенных карбоновых кислот изменяется в следующем порядке:
 Присутствие донорных заместителей в алкильном радикале увеличивает электронную плотность на карбоксилат-анионе и протон сильнее удерживается им.
Присутствие донорных заместителей в алкильном радикале увеличивает электронную плотность на карбоксилат-анионе и протон сильнее удерживается им.
В этом ряду муравьиная кислота обладает большими кислыми свойствами, чем уксусная.
Карбоновые кислоты взаимодействуют с активными металлами, гидроксидами металлов, солями:


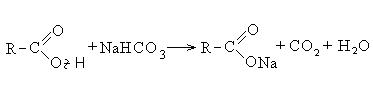
II Реакции с разрывом связи С-ОН (направление II).
Реакции с разрывом связи С-ОН протекают по механизму нуклеофильного замещения (SN) и приводят к образованию так называемых функциональных производных карбоновых кислот. К ним относятся:




Механизм реакций нуклеофильного замещения сводится к следующему:
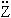 - нуклеофил.
- нуклеофил.
1. Образование хлорангидридов карбоновых кислот:

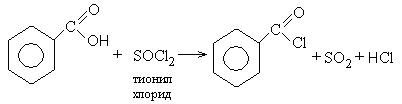
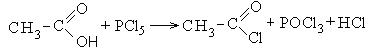

Хлорангидриды карбоновых кислот являются реакционно способным классом соединений и широко используются в органическом синтезе для получения диоксикетонов и карбоновых кислот:

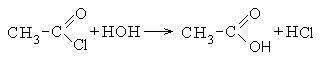
2. Образование ангидридов карбоновых кислот:

Ангидриды карбоновых кислот также являются реакционно-способными соединениями. Ангидрид уксусной кислоты используется как ацелирующий агент:
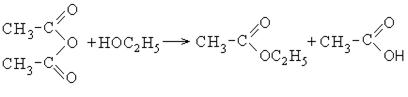
При растворении уксусного ангидрида в воде образуется уксусная кислота.
3. Образование амидов карбоновых кислот:

4. Образование сложных эфиров:

III. Реакции в углеводородном радикале (направление III). Эти реакции протекают по механизму радикального замещения (SR):

Кроме выше перечисленных направлений взаимодействия карбоновые кислоты вступают в реакции окисления. Окисление карбоновых кислот протекает в жестких условиях с образованием оксикислот. В неразветвленных карбоновых кислотах окисление проходит в β - положении, а в разветвленных – в α -положении к углероду карбонильной группы:


26. Непредельные кислот и их свойства.
СН2=СН–СООН – пропеновая (акриловая)
СН2=СН–СН2–СООН – бутеновая (винилуксусная)
СН3–СН=СН–СООН – кортоновая
С17Н33СООН – олеиновая
С17Н31СООН – линолевая
С17Н29СООН – линоленовая
С19Н31СООН – арахидоновая
I. Свойства группы –СООН:
А) диссоциация
Б) получение солей
В) получение амидов
Г) получение ангидридов
Д) получение эфиров
II. свойства двойной связи:
1. Присоединение Н2
СН2=СН–СООН + Н2 → СН3–СН2–СООН
2. Присоединение галогенов (Cl2, Br2, I2).
СН2=СН–СООН + Cl2 → СН2Cl–СНCl–СООН
3. Присоединение HCl (не по правилу Марковникова)

 δ –
δ –
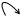 δ + δ – δ +
δ + δ – δ +
СН2=СН + H+Cl– → CH2Cl–CH2–COOH
4.  Присоединение H2О (не по правилу Марковникова)
Присоединение H2О (не по правилу Марковникова)
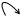 δ + δ –
δ + δ –
 СН2=СН + H+OH– → CH2–CH2–COOH
СН2=СН + H+OH– → CH2–CH2–COOH
5. Окисление [O]


 R–CH=CH–COOH R–CH–CH–COOH
R–CH=CH–COOH R–CH–CH–COOH
27. Дикарбоновые кислоты.


28. Гидроксикислоты. Их свойства.
-это карбоновые кислоты, содержащие одну или несколько гидроксильных групп.