
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ЗАДАНИЯ. 1. Теория строения органических соединений А.М.Бутлерова
|
|
ВОПРОСЫ
1. Теория строения органических соединений А.М.Бутлерова. Предпосылки создания теории строения. Основные положения теории строения А.М.Бутлерова. Понятие об изомерии.
2. Гомологический ряд алканов. Особенности строения предельных углеводородов. Алканы как представители предельных углеводородов. Химические свойства алканов Применение алканов.
3. Циклоалканы. Гомологический ряд и номенклатура циклоалканов, их общая формула. Химические свойства циклоалканов.
4. Гомологический ряд алкенов. Строение молекулы этилена. Гомологический ряд и общая формула алкенов. Химические свойства алкенов.
5. Применение и способы получения алкенов.
6. Основные понятия химии высокомолекулярных соединений. Мономер, полимер, реакция полимеризации, степень полимеризации, структурное звено. Структуры полимеров. Свойства полимеров.
7. Представление о пластмассах. Полиэтилен, его свойства и применение. Полипропилен, его применение и свойства.
8. Каучуки натуральный и синтетические.
9. Гомологический ряд алкинов. Сроение ацетилена. Гомологический ряд и общая формула алкинов. Химические свойства и применение алкинов.
10. Бензол как представитель аренов. Физические и химические свойства. Применение и получение бензола.
11. Нефть. Нахождение в природе, состав и физические свойства нефти. Промышленная переработка нефти.
12. Природный и попутный нефтяной газы. Сравнение состава природного и попутного газов, их практическое использование.
13. Гомологический ряд предельных одноатомных спиртов. Химические свойства алканолов. Способы получения спиртов. Применение метанола и этанола.
14. Многоатомные спирты. Особенности химических свойств многоатомных спиртов, их качественное обнаружение. Отдельные представители: этиленгликоль, глицерин, практическое применение.
15. Фенол. Строение фенола. Химические свойства фенола как функция его химического строения. Применение фенола.
16. Гомологический ряд альдегидов Химические свойства альдегидов. Применение и получение карбонильных соединений.
17. Гомологический ряд предельных одноосновных карбоновых кислот. Химические свойства карбоновых кислот.
18. Сложные эфиры. Строение и номенклатура сложных эфиров. Способы получения сложных эфиров.
19. Жиры. Жиры как сложные эфиры глицерина. Карбоновые кислоты, входящие в состав жиров. Зависимость консистенции жиров от их состава. Химические свойства жиров: гидролиз, омыление, гидрирование. Биологическая роль жиров, их использование в быту и промышленности.
20. Понятие об углеводах. Классификация углеводов. Моно-, ди- и полисахариды, представители каждой группы углеводов.
21. Глюкоза, строение ее молекулы и физические свойства. Химические свойства глюкозы: реакции по альдегидной группе и как многоатомного спирта. Различные типы брожения (спиртовое, молочнокислое). Глюкоза в природе. Биологическая роль и применение глюкозы.
22. Крахмал. Строение молекулы крахмал. Физические свойства крахмала, его нахождение в природе и биологическая роль. Химические свойства крахмала.
23. Целлюлоза. Строение элементарного звена целлюлозы. Нахождение в природе и биологическая роль целлюлозы.
24. Классификация аминов. Химические свойства аминов. Амины как органические основания.
25. Анилин – представитель ароматических аминов. Строение, свойства, получение и применение.
26. Аминокислоты. Номенклатура аминокислот. Двойственность кислотно-основных свойств. Получение аминокислот, их применение и биологическая функция.
27. Белки. Белки как природные полимеры. Первичная, вторичная, третичная и четвертичная структуры белков. Фибриллярные и глобулярные белки.
28. Химические свойства белков: горение, денатурация, гидролиз, качественные (цветные) реакции. Биологические функции белков, их значение. Белки как компонент пищи.
29. Нуклеиновые кислоты. Нуклеиновые кислоты как природные полимеры. Нуклеотиды, их строение, примеры. Понятие ДНК и РНК. Строение ДНК, ее первичная и вторичная структура.
30. Ферменты. Понятие о ферментах как о биологических катализаторах белковой природы. Особенности строения и свойств в сравнении с неорганическими катализаторами. Значение ферментов в биологии и применение в промышленности.
31. Витамины. Понятие о витаминах. Их классификация и обозначение. Норма потребления витаминов. Водорастворимые (на примере витаминов С, группы В и Р) и жирорастворимые (на примере витаминов А, D и Е).
32. Волокна. Классификация. Характеристика лавсана, капрона и ацетатного волока.
33. Атом — сложная частица. Состав атомного ядра.
34. Электронная оболочка атомов. Распределение электронов по энергетическим уровням, подуровням и орбиталям. Электронные конфигурации атомов химических элементов.
35. Открытие периодического закона. Работы предшественников (И.В.Деберейнера, А.Э.Шанкуртуа, Дж.А.Ньюлендса, Л.Ю.Мейера. Открытие Д.И.Менделеевым Периодического закона.
36. Периодический закон и строение атома. Изотопы. Современное понятие химического элемента. Современная формулировка Периодического закона. Периодическая система и строение атома. Физический смысл порядкового номера элементов, номеров группы и периода.
37. Ковалентная химическая связь. Типы кристаллических решеток у веществ с этим типом связи: атомные и молекулярные. Физические свойства веществ с этими кристаллическими решетками.
38. Ионная химическая связь. Ионные кристаллические решетки и свойства веществ с такими кристаллами.
39. Металлическая химическая связь. Металлические кристаллические решетки и свойства веществ с такими кристаллами.
40. Водородная химическая связь
41. Понятие о дисперсных системах. Классификация дисперсных систем в зависимости от агрегатного состояния дисперсионной среды и дисперсной фазы, а также по размеру их частиц.
42. Классификация химических реакций в органической и неорганической химии.
43. Скорость химических реакций. Понятие о скорости реакций. Скорость гомо- и гетерогенной реакции.
44. Факторы, влияющие на скорость химической реакции. Природа реагирующих веществ. Температура (закон Вант—Гоффа). Концентрация.
45. Теория электролитической диссоциации. Основные положения теории электролитической диссоциации.
46. Реакции обмена в водных растворах электролитов.
47. Окислительно-восстановительные реакции. Степень окисления. Восстановители и окислители. Окисление и восстановление.
48. Металлы. Положение металлов в периодической системе и особенности строения их атомов. Общие физические свойства металлов и их восстановительные свойства: взаимодействие с неметаллами (кисло
49. Коррозия металлов. Понятие коррозии. Химическая коррозия. Электрохимическая коррозия. Способы защиты металлов от коррозии.
50. Общие способы получения металлов. Металлы в природе. Металлургия и ее виды: пиро-, гидро- и электрометаллургия.
51. Неметаллы. Положение неметаллов в Периодической системе, особенности строения их атомов. Химические свойства неметаллов.
52. Водородные соединения неметаллов.
53. Кислоты. Классификация кислот. Общие свойства кислот: взаимодействие с металлами, основными и амфотерными оксидами и гидроксидами, солями.
54. Алюминий. Характеристика алюминия на основании положения в Периодической системе элементов Д.И.Менделеева и строения атома. Получение, физические и химические свойства алюминия.
55. Химия и производство. Химическая промышленность и химические технологии. Научные принципы химического производства. Сырье для химической промышленности. 56. Вода в химической промышленности. Энергия для химического производства. Защита окружающей среды и охрана труда при химическом производстве.
ЗАДАНИЯ
1. Осуществите превращения:
Cr → Cr2O3 → Cr2(SO4)3 → Cr(OH)3 → CrCl3
↓
Cr(NO3)3
2. Осуществите превращения:
Si → SiO2 → Na2SiO3 → H2SiO3
↓
SiH4
3. Методом электронного баланса расставить коэффициенты:
KMnO4 + Na2SO3 + KOH = K2MnO4 + Na2SO4 + H2O
4. С какими из перечисленных веществ будет вступать в реакцию cоляная кислота? Напишите уравнения соответствующих реакций. Pt, Fe, MgO, NaCl, KOH.
5.Определите, как изменится скорость химической реакции при изменении температуры от 0° С до 30° С, если ɤ =2.
6. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CuSO4 и Н2S; б) ВаСO3 и НNO3; в) FeCl3 и КOH.
7. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
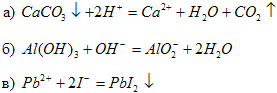
8. Выпишите формулы оксидов, кислот, оснований и солей из предложенного списка веществ:
Na, Na2O2, Na2CO3, NaNO, 3 Ca, CaO, Ca(OH)2, Ca(H2PO4)2, Ca3(PO4)2, NH3, (NH4)2SO4, NO, NO2, HNO3, NaNO3, H2S, S, SO2, NaHSO3, NaBr, Cl2, KClO3.
9. Дайте характеристику химической реакции, расставьте коэффициенты:
Na + H2O =H2 + NaOH + Q
тв ж г ж
10. Напишите уравнения реакций взаимодействия 2-метилбутена-2 и следующих веществ: хлор, бромоводород, водород, вода.
11. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Br2, свет КОН, спирт НBr Na



 СН3 – СН2 – СН(СН3) – СН3 Х1 Х2 Х1 Х3 → СО2
СН3 – СН2 – СН(СН3) – СН3 Х1 Х2 Х1 Х3 → СО2
12. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
С6Н12О6→ С2Н5ОН→ CH3-CHO→ CH3-COOH→ ClCH2-COOH → NH2CH2 -COOH
13. Напишите уравнения реакций взаимодействия 2-метилбутаналя и следующих веществ: оксид серебра, гидроксид меди, водород.
14. Составьте уравнения реакций, которые надо провести для осуществления следующих превращений: Cu → Cu(NO3)2 → Cu(OH)2 → CuCl2.
15. Вычислите массу хлорида натрия и воды, необходимых для приготовления 500 г раствора, в котором массовая доля NaCl 5%.
16. Вычислите по термохимическому уравнению реакции количество теплоты, выделяющейся при сгорании 1 кг серы.
S + O2 = SO2 + 297 кДж
17. Какую массу Na2CO3 необходимо взять для приготовления 20 мл раствора с молярной концентрацией 0, 1 моль/л?
18. Вычислите объем хлора, который потребуется для реакции с водородом объемом
22, 4 л.
19. Вычислите объем водорода, выделившегося при взаимодействии метанола (СН3ОН) с натрием массой 9, 2 г.
20. Какое вещество и сколько его выпадет в осадок при взаимодействии 50 г 20%-ного раствора FeCl3 с раствором КОН?
21. Какой объем кислорода потребуется для полного сгорания 0, 056 л водорода?
22. Укажите вид химической связи в молекулах веществ: HNO3, Cr2O3, Na2SiO3, K2MnO4, SiO2, H2, Na, СО2, SO3. Определите степень окисления элементов.
23. Сколько грамм метана (СН4) необходимо сжечь для получения 5 моль углекислого газа?
24. 200 г этилового спирта (С2Н5ОН), содержащего 4% примесей, нагрели с концентрированной серной кислотой. Какой объем этилена (С2Н4) образовался при этом?
25. Вычислите массу KCl, необходимую для приготовления раствора объемом 25 мл с молярной концентрацией 0.2 моль/л.
26. Какова масса Н2, выделившегося при взаимодействии цинка с раствором соляной кислоты массой 50 г, массовая доля HCl в котором 10%?
27. Методом электронного баланса расставить коэффициенты:
KMnO4 + Na2SO3 + Н2О = MnO2 + Na2SO4 + КОН
28. Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeO → FeCl2 → Fe(OH)2 → FeSO4
↓
Fe(NO3)2
|